Cosa è, diagramma di energia molecolare ed esercizio fisico
- 2419
- 298
- Silvano Montanari
IL trasmissione L'ottica è il quoziente tra l'intensità della luce emergente e l'incidente di intensità della luce su un campione di soluzione traslucida che è stata illuminata con luce monocromatica.
Viene chiamato il processo fisico del passaggio della luce attraverso un campione trasmissione luminosa e il trasmissione È una misura della trasmissione della luce. La trasmittanza è un valore importante per determinare la concentrazione di un campione generalmente sciolto in un solvente come acqua o alcol, tra gli altri.
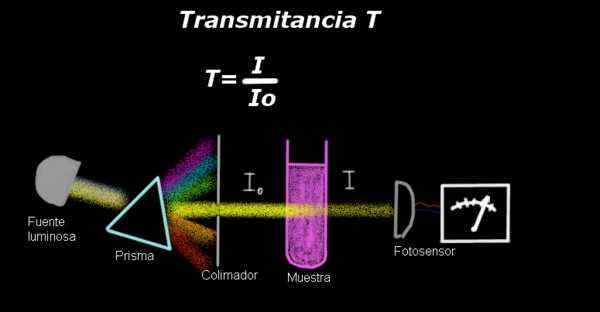
 Figura 1. Assemblaggio per la misurazione della trasmittanza. Fonte: f. Zapata.
Figura 1. Assemblaggio per la misurazione della trasmittanza. Fonte: f. Zapata. Un elettro-fotometro misura una corrente proporzionale all'intensità della luce che influisce sulla sua superficie. Per calcolare la trasmittanza, il segnale dell'intensità corrispondente al solo solvente viene generalmente misurato e questo risultato viene registrato come Io.
Quindi il campione si è sciolto nel solvente con le stesse condizioni di illuminazione e il segnale misurato dall'elettro-fotometro è indicato in quanto è indicato come indicato come Yo, Quindi la trasmittanza viene calcolata secondo la seguente formula:
T = i / iO
Va notato che la trasmittanza è una quantità senza dimensioni, poiché è una misura dell'intensità della luce di un campione in relazione all'intensità della trasmissione del solvente.
[TOC]
Cos'è la trasmittanza?
Assorbimento della luce in un mezzo
Quando la luce passa attraverso un campione, parte dell'energia della luce viene assorbita dalle molecole. La trasmittanza è la misura macroscopica di un fenomeno che si verifica a livello molecolare o atomico.
La luce è un'onda elettromagnetica, l'energia che trasporta si trova nel campo elettrico e magnetico dell'onda. Questi campi oscillanti interagiscono con le molecole di una sostanza.
Può servirti: Modello atomico Rutherford: storia, esperimenti, postulatiL'energia che trasporta l'onda dipende dalla sua frequenza. La luce monocromatica ha solo una frequenza, mentre la luce bianca ha un intervallo di frequenza o uno spettro.
Tutte le frequenze di un'onda elettromagnetica viaggiano nel vuoto alla stessa velocità di 300000 km/s. Se denotiamo da C Alla velocità della luce nel vuoto, la relazione tra frequenza F e lunghezza d'onda λ È:
C = λ⋅f
COME C È una costante ad ogni frequenza corrisponde alla rispettiva lunghezza d'onda.
Per misurare la trasmittanza di una sostanza, vengono utilizzate le regioni dello spettro elettromagnetico visibile (380 nm a 780 nm), vengono utilizzate la regione ultravioletta (da 180 a 380 nm) e quella dell'infrarosso (780 nm a 5600 nm)
La velocità di propagazione della luce in un mezzo di materiale dipende dalla frequenza ed è inferiore a C. Questo spiega la dispersione in un prisma con cui le frequenze che compongono la luce bianca possono essere separate.
Teoria molecolare dell'assorbimento della luce
Atomi e molecole hanno livelli di energia quantificati. A temperatura ambiente, le molecole sono ai loro livelli di energia più bassi.
Il fotone è la particella quantistica associata all'onda elettromagnetica. Anche l'energia Foton è quantizzata, cioè un fotone di frequenza F Ha energia data da:
E = H⋅f
Dove H È costante di Planck il cui valore è 6,62 × 10^-34 J⋅s.
La luce monocromatica è un raggio di fotoni di frequenza e una data energia.
Le molecole assorbono i fotoni quando la loro energia coincide con la differenza necessaria per portare la molecola a un livello di energia più elevato.
Le transizioni energetiche mediante assorbimento di fotoni nelle molecole possono essere di diversi tipi:
Può servirti: motore a gabbia scoiattolo1- Transizioni elettroniche, quando gli elettroni degli orbitali molecolari passano all'orbitale di maggiore energia. Queste transizioni di solito si verificano nell'intervallo visibile e ultravioletto e sono le più importanti.
2- Transizioni vibrazionali, anche le energie del legame molecolare sono quantizzate e quando un fotone della regione a infrarossi viene assorbita la molecola passa a uno stato di energia vibrazionale più elevato.
3- Transizioni rotazionali, quando l'assorbimento di un fotone porta alla molecola a uno stato rotazionale di maggiore energia.
Diagramma di energia molecolare
Queste transizioni sono meglio comprese con un diagramma di energia molecolare mostrato nella Figura 2:
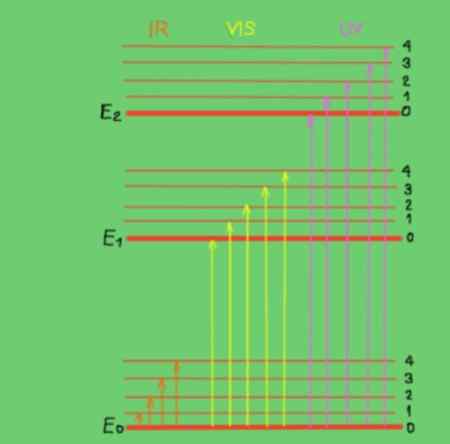 figura 2. Diagramma di energia molecolare. Fonte: f. Zapata.
figura 2. Diagramma di energia molecolare. Fonte: f. Zapata. Nel diagramma le linee orizzontali rappresentano diversi livelli di energia molecolare. La linea E0 è un livello di energia fondamentale o inferiore. I livelli di E1 ed E2 sono livelli eccitati di maggiore energia. I livelli E0, E1, E2 corrispondono agli stati elettronici della molecola.
I livelli secondari 1, 2, 3, 4 all'interno di ciascun livello elettronico corrispondono ai diversi stati vibrazionali corrispondenti a ciascun livello elettronico. Ognuno di questi livelli ha le migliori suddivisioni che non sono mostrate che corrispondono agli stati di rotazione associati a ciascun livello vibrazionale.
Il diagramma mostra frecce verticali che rappresentano l'energia dei fotoni nella gamma infrarossa, visibile e ultravioletta. Come si può vedere i fotoni a infrarossi non hanno abbastanza energia per promuovere le transizioni elettroniche, invece radiazioni visibili e ultraviolette sì.
Quando i fotoni incidenti di un raggio monocromatico coincidono in energia (o frequenza) con la differenza di energia tra gli stati di energia molecolare, si verifica l'assorbimento di fotoni.
Può servirti: scale termometricheFattori a seconda della trasmittanza
Secondo quanto detto nella sezione precedente, la trasmittanza dipenderà quindi da diversi fattori tra cui possiamo nominare:
1- la frequenza con cui si illumina il campione.
2- Il tipo di molecole che si desidera analizzare.
3- La concentrazione della soluzione.
4- La lunghezza del percorso viaggiava attraverso il raggio di luce.
I dati sperimentali indicano che la trasmissione T diminuisce esponenzialmente con la concentrazione C e con la lunghezza L del percorso ottico:
T = 10-A⋅c⋅l
Nell'espressione precedente A È una costante che dipende dalla frequenza e dal tipo di sostanza.
Esercizio risolto
Esercizio 1
Un campione di pattern di una certa sostanza ha una concentrazione di 150 micromoli per litro (μM). Quando viene misurata la trasmittanza con 525 nm, si ottiene una trasmissione 0 0.4.
Un altro campione della stessa sostanza, ma di concentrazione sconosciuta ha una trasmittanza 0.5, se misurato alla stessa frequenza e con lo stesso spessore ottico.
Calcola la concentrazione del secondo campione.
Risposta
La trasmittanza T decade esponenzialmente con la concentrazione C:
T = 10-B⋅l
Se prendi il logaritmo dell'uguaglianza precedente, rimane:
log t = -b⋅c
Dividi membro con membro La precedente uguaglianza applicata a ciascun campione e compensare la concentrazione sconosciuta rimane:
C2 = C1⋅ (log t2 / log t1)
C2 = 150μm⋅ (log 0.5 / log 0.4) = 150μm⋅ (-0.3010 / -0.3979) = 113.5μm
Riferimenti
- Atkins, p. 1999. Chimica fisica. Omega Editions. 460-462.
- La guida. Trasmittanza e assorbanza. Recuperato da: chimica.Laguia2000.com
- Tossicologia ambientale. Trasmittanza, assorbanza e legge di Lambert. Recuperato da: repository.Innovationumh.È
- Fisica dell'avventura. Assorbanza e trasmittanza. Recuperato da: rpfisica.Blogspot.com
- Sistofotometria. Recuperato da: Chem.Librettexts.org
- Tossicologia ambientale. Trasmittanza, assorbanza e legge di Lambert. Recuperato da: repository.Innovationumh.È
- Wikipedia. Trasmissione. Recuperato da: Wikipedia.com
- Wikipedia. Spettrofotometria. Recuperato da: Wikipedia.com
- « Origine MIXCóatl, caratteristiche, rituali
- Fase dell'indipendenza del background e dello sviluppo del Messico »

