Struttura del nitrato di zinco, proprietà, ottenimento, usi

- 1989
- 93
- Rosolino Santoro
Lui nitrato di zinco È un composto inorganico formato dagli elementi di zinco (Zn), azoto (N) e ossigeno (O) (O). Lo stato di ossidazione dello zinco è +2, quello dell'azoto è +5 e l'ossigeno è -2.
La sua formula chimica è Zn (no3)2. È un solido cristallino incolore che tende ad assorbire l'acqua dall'ambiente. Può essere ottenuto trattando il metallo di zinco con acido nitrico diluito. È un composto fortemente ossidante.
 Nitrato FIFR Zn (no3)2. Dominio Ondřej mangl / pub. Fonte: Wikimedia Commons.
Nitrato FIFR Zn (no3)2. Dominio Ondřej mangl / pub. Fonte: Wikimedia Commons. Serve come acceleratore di reazioni di chimica organica e consente di ottenere polimeri composti con proprietà di guida elettrica. Viene utilizzato per formare strati di materiali utili in elettronica.
Fa parte di alcuni fertilizzanti liquidi e alcuni erbicidi a rilascio lento. Aiuta nella preparazione di ossidi complessi che migliorano la densità e la conducibilità elettrica.
È stato testato con successo per ottenere strutture che fungono da base per la rigenerazione e la crescita del tessuto osseo, migliorando questo processo e risultando in un antibatterico.
Sebbene non sia carburante, può accelerare la combustione di sostanze che sono, come il carbone o i materiali organici. È pelle irritante, occhi e mucose ed è molto tossico per la vita acquatica.
[TOC]
Struttura
Il nitrato di zinco è un composto ionico. Ha un catione bivalente (Zn2+) e due anioni monovalenti (no3-). L'anione di nitrato è uno ione poliiatomico formato da un atomo di azoto nel suo stato di ossidazione +5 attaccato a tre atomi di ossigeno con valencia da -2.
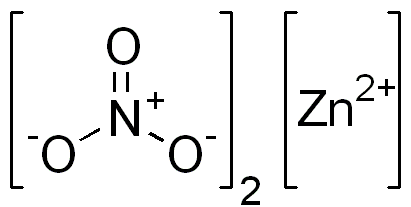 Struttura di nitrato ionico di zinco. Dominio EDGAR181 / PUB. Fonte: Wikimedia Commons.
Struttura di nitrato ionico di zinco. Dominio EDGAR181 / PUB. Fonte: Wikimedia Commons. L'immagine sotto mostra la struttura spaziale di questo composto. La sfera centrale grigia è zinco, le sfere blu sono azoto e le sfere rosse rappresentano ossigeno.
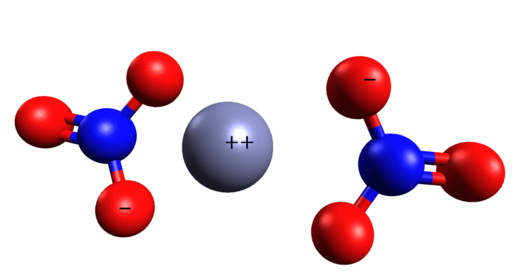 Struttura spaziale di Zn (no3)2. Cinc è nel mezzo degli ioni di nitrato. Grasso Luigi/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons.
Struttura spaziale di Zn (no3)2. Cinc è nel mezzo degli ioni di nitrato. Grasso Luigi/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons. Nomenclatura
- Nitrato Cinc
- Dinitrato di zinco
Proprietà
Stato fisico
Bianco incolore solido o cristallino.
Peso molecolare
189,40 g/mol
Punto di fusione
Circa 110 ºC.
Può servirti: acido iaridrico (HI): struttura, proprietà e usiPunto di ebollizione
Circa 125 ºC.
Densità
2.065 g/cm3
Solubilità
Acqua Solubile: 120 g/100 g H2O a 25 ° C. Alcol solubile.
ph
Le sue soluzioni acquose sono acide. Una soluzione al 5% ha un pH di circa 5.
Proprietà chimiche
Per essere un nitrato, questo composto è un forte ossidante. Reagisce violentemente con carbone, rame, solfuri metallici, materia organica, fosforo e zolfo. Se viene spruzzato su exploit di carbone caldo.
D'altra parte, è igroscopico e assorbe l'acqua dall'ambiente. Se si forma ossido di zinco, biossido di azoto e ossigeno:
2 Zn (no3)2 + calore → 2 ZnO + 4 no2↑ + o2↑
Nelle soluzioni alcaline, come quelle di NaOH, lo zinco di questo composto costituisce il suo idrossido e altre specie complesse:
Zn (n3)2 + 2 Oh- → Zn (OH)2 + 2 n3-
Zn (oh)2 + 2 Oh- → [Zn (OH)4"2-
Ottenimento
Può essere ottenuto trattando lo zinco o l'ossido di zinco con acido nitrico diluito. L'idrogeno si forma in questa reazione.
Zn + 2 HNO3 → Zn (no3)2 + H2↑
Applicazioni
Catalisi delle reazioni
Viene usato come catalizzatore per ottenere altri composti chimici come resine e polimeri. È un catalizzatore acido.
 Esempio di resina. Bugman in inglese Wikipedia / Dominio pubblico. Fonte: Wikimedia Commons.
Esempio di resina. Bugman in inglese Wikipedia / Dominio pubblico. Fonte: Wikimedia Commons.  Modello di struttura polimerica. Dominio ilmari karonen / pub. Fonte: Wikimedia Commons.
Modello di struttura polimerica. Dominio ilmari karonen / pub. Fonte: Wikimedia Commons. Un altro caso di accelerazione delle reazioni è il sistema catalitico di Zn (no3)2/Voc2O4, che consente l'ossidazione di α-idrolisori a stress α-α con conversione al 99% anche a pressione e temperatura ambientale.
Nei polimeri composti
Sono stati sviluppati film di polimetilmetacrilato e Zn (no3)2 con proprietà di conducibilità elettrica che le rendono i candidati appropriati da utilizzare in supercaughi e computer ad alta velocità.
In cementi di ossyst
Con soluzioni acquose di nitrato di zinco e polvere di ossido di zinco, si ottengono materiali appartenenti alla classe di cementi generati da una reazione a base di acido.
Questi hanno una ragionevole resistenza a dissolversi in acidi diluiti e alcali, sviluppando la compressione della resistenza alla compressione rispetto a quella di altri cementi.
Questa proprietà aumenta quando il rapporto ZnO/Zn è aumentato (no3)2, E quando la concentrazione di Zn viene caricata (no3)2 Nella soluzione. I cementi ottenuti sono completamente amorfi, cioè non hanno cristalli.
Può servirti: precipitazioni chimiche Con il nitrato di zinco, sono stati eseguiti test per ottenere cementi. Autore: Kobthanapong. Fonte: Pixabay.
Con il nitrato di zinco, sono stati eseguiti test per ottenere cementi. Autore: Kobthanapong. Fonte: Pixabay. In rivestimenti e nanomateriali di ossido di zinco
Lo Zn (no3)2 È usato per la deposizione elettrolitica di strati molto sottili di ossido di zinco (ZnO) su vari substrati. Le nanostrutture di questo ossido sono anche preparate sulle superfici.
 Nanoparticelle di ossido di zinco. Alcune nanostrutture ZnO possono essere preparate con Zn (no3)2. Verena Wilhelmi, Ute Fischer, Heike Pesordt, Klaus Schulze-Osthoff, Carmen Nickel, Burkhard Stahlmecke, Thomas a. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/CC di (https: // creativeCommons.Org/licenze/by/2.5). Fonte: Wikimedia Commons.
Nanoparticelle di ossido di zinco. Alcune nanostrutture ZnO possono essere preparate con Zn (no3)2. Verena Wilhelmi, Ute Fischer, Heike Pesordt, Klaus Schulze-Osthoff, Carmen Nickel, Burkhard Stahlmecke, Thomas a. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/CC di (https: // creativeCommons.Org/licenze/by/2.5). Fonte: Wikimedia Commons. ZnO è un materiale di grande interesse a causa della moltitudine di applicazioni nel campo dell'optolettronica, ha anche proprietà dei semiconduttori e viene utilizzato in sensori e trasduttori.
Negli erbicidi
Il nitrato Cinc è stato usato insieme ad alcuni composti organici per ridurre la velocità di rilascio di alcuni erbicidi in acqua. Il rilascio lento di questi prodotti consente loro di essere disponibili per le applicazioni più lunghe e meno.
Nella produzione di anod
Stimola il processo di sinterizzazione e migliora la densità di alcuni ossidi che servono a fare anod per le celle a combustibile. La sinterizzazione sta ottenendo un materiale solido attraverso il riscaldamento e la compressione di una polvere senza raggiungere la sua fusione.
 Disegnare come si verifica due cereali. Lo Zn (no3)2 Aiutare nell'esecuzione di questo processo su alcuni ossidi complessi. Dominio cdang / pub. Fonte: Wikimedia Commons.
Disegnare come si verifica due cereali. Lo Zn (no3)2 Aiutare nell'esecuzione di questo processo su alcuni ossidi complessi. Dominio cdang / pub. Fonte: Wikimedia Commons. I materiali in cui sono stati eseguiti i test sono ossidi complessi di stronzio, iridio, ferro e titanio. La presenza di FAL aumenta significativamente la conduttività elettrica di questi.
Altre app
È usato per ottenere farmaci. Agisce come un mordente nell'applicazione di inchiostri e coloranti. Funge da coagulante in lattice. È una fonte di zinco e azoto nei fertilizzanti liquidi.
Potenziale utilizzo nell'ingegneria dei tessuti ossei
Questo composto è stato usato come additivo nell'elaborazione di armature o frame per la rigenerazione delle fibre ossee, poiché consente di migliorare la resistenza meccanica di queste strutture.
Può servirti: germanio: storia, proprietà, struttura, ottenimento, usiÈ stato osservato che l'impalcatura che contiene fift non è tossico per le cellule osteoprogenitrici, supporta l'attività degli osteoblasti che sono le cellule che producono osso e migliorano la loro adesione e proliferazione.
Favorisce la formazione di apatita che è il minerale che forma le ossa e esercita anche un effetto antibatterico.
 Lo Zn (no3)2 Potrebbe essere molto utile per la ricostruzione della materia ossea nelle persone che hanno subito incidenti. Mariano Coretti/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons.
Lo Zn (no3)2 Potrebbe essere molto utile per la ricostruzione della materia ossea nelle persone che hanno subito incidenti. Mariano Coretti/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons. Rischi
È un materiale con potenziale rischio di incendio ed esplosione.
Non è carburante ma accelera la combustione di materiali combustibili. Se una grande quantità di questo composto è coinvolta in un incendio o se il materiale combustibile è finemente diviso, può verificarsi un'esplosione.
Se sottoposto a calore forte, vengono prodotti ossidi di azoto tossici. E se l'esposizione viene eseguita prolungata, può esplodere.
È irritante per la pelle, può causare gravi danni agli occhi, irritazione nel tratto respiratorio, è tossico a causa dell'ingestione e provoca danni al tratto digestivo.
Molto tossico per la vita acquatica con gli effetti che durano.
Riferimenti
- JU, e. et al. (2019). Nuovo effetto del nitrato di zinco/vanadil oxalato per ossidazione catalitica selettiva degli esteri alfa-idrossi in eser alfa-cheto con ossigeno molecolare: un in situ. Molecole 2019, 24, 1281. MDPI si è ripreso.com.
- Mohd s., S.N. et al. (2020). Formulazione a rilascio controllato di nitrato di idrossido di zinco intercalato con dodecilsolfi di sodio e anioni bispyribac: un nuovo nanocomposito erbicida per la coltivazione di risaia. Arabian Journal of Chemistry 13, 4513-4527 (2020). Recuperato da ScienceDirect.
- Uomo, m.P. et al. (2019). Resistenza meccanica arricchita e mineralizzazione ossea di impalcature biomimetiche elettrospun carichi di olio ylang ylang e nitrato di zinco per ingegneria dei tessuti ossei. Polimeri 2019, 11, 1323. MDPI si è ripreso.com.
- Kim, k.Yo. et al. (2018). Effetti del nitrato di zinco come un aiuto sinterizzato sulle caratteristiche elettochimiche di SR0.92E0,08Zio3-delta e Mr0.92E0,08Voi0.6Fede0.4O3-delta Ceramics International, 44 (4): 4262-4270 (2018). Recuperato da ScienceDirect.com.
- Prasad, b.E. et al. (2012). Elettrodeposizione del rivestimento ZnO da Zn acquoso (no3)2 Bagni: effetto della concentrazione di Zn, deposizione di temperatura e tempo sull'orientamento. J Solid State Electochem 16, 3715-3722 (2012). Link recuperato.Springer.com.
- Bahadur, h. e srivastava, a.K. (2007). Morfologie di film sottili derieri di sol-gel di ZnO utilizzando materiali precursori diversi e le loro nanostrutture. Nanoscale Res Lett (2007) 2: 469-475. Link recuperato.Springer.com.
- Nicholson, J.W. e Tibaldi, J.P. (1992). Formazione e proprietà del cemento preparato da ossido di zinco e soluzioni acquose di nitrato di zinco. J Mater Sci 27, 2420-2422 (1992). Link recuperato.Springer.com.
- Piombo, d.R. (Editor) (2003). Manuale CRC di chimica e fisica. 85th CRC Press.
- Maji, p. et al. (2015). Effetto di Zn (no3)2 Filler sulla demillity dielettrica e il modulo elettrico di PMMA. Bull Mater Sci 38, 417-424 (2015). Link recuperato.Springer.com.
- O.S. Biblioteca nazionale di medicina. (2019). Nitrato di zinco. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Byju's. (2020). Nitrato di zinco - Zn (NO3) 2. Recuperato da Byjus.com.
- Elementi americani. Nitrato di zinco. Recuperato dagli americani.com.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- « Struttura di cloruro di zinco (ZnCl2), proprietà, ottenimento, usi
- Casi concreti di procedimenti etici in istituzioni e organizzazioni »

