Struttura di cloruro di zinco (ZnCl2), proprietà, ottenimento, usi

- 2680
- 458
- Benedetta Rinaldi
Lui cloruro di zinco È un composto inorganico formato dall'elemento di zinco o zinco (Zn) e cloro (CL). La sua formula chimica è ZnCl2. Cinc si trova nello stato di ossidazione +2 e il cloro ha un valencia di -1.
È un solido cristallino incolore o bianco. È molto solubile in acqua e lo assorbe facilmente dall'ambiente, che può essere visto nella figura del solido inumidito mostrato di seguito.
 Cloruro FIFCL2 solido un po 'idratato. Utente: Walkerma / Public Domain. Fonte: Wikimedia Commons.
Cloruro FIFCL2 solido un po 'idratato. Utente: Walkerma / Public Domain. Fonte: Wikimedia Commons. Lo zinco di questo composto è biologicamente molto importante per l'uomo, gli animali e le piante, poiché interviene in funzioni di base come la sintesi di proteine e grassi.
Per questo motivo lo ZnCl2 È usato come complemento nutrizionale per animali e umani in caso di carenza di zinco e come micronutriente per le piante.
Ha proprietà batteriostatiche e astringenti ed è ampiamente usato per questi scopi nella medicina sia umana che veterinaria. Elimina anche i parassiti come i funghi esterni ed è intermedia per ottenere pesticidi.
Tra i suoi molteplici usi serve a trattare le fibre di cellulosa e lana in vari processi, nonché per prepararli per il colore o la stampa. Ritardare anche la combustione del legno.
[TOC]
Struttura
Lo Zncl2 È un composto ionico formato dal cationing Zn2+ e due anioni cloruro cl- che si legano attraverso le forze elettrostatiche.
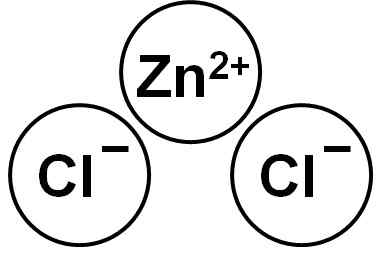 Cloruro di zinco. Autore: Marilú Stea.
Cloruro di zinco. Autore: Marilú Stea. Lo ione di zinco (ii) ha la seguente struttura elettronica:
1s2, 2s2 2 p6, 3s2 3p6 3d10, 4s0,
in cui si osserva che entrambi gli elettroni del mantello 4s, per cui la configurazione è stabile.
Lo ione cloruro presenta la seguente struttura:
1s2, 2s2, 2 p6, 3s2 3p6,
che è anche molto stabile per avere orbitali completi.
Nella figura, è possibile osservare il modo in cui gli ioni sono disponibili nel vetro. Le sfere grigie rappresentano le sfere di zinco e verde al cloro.
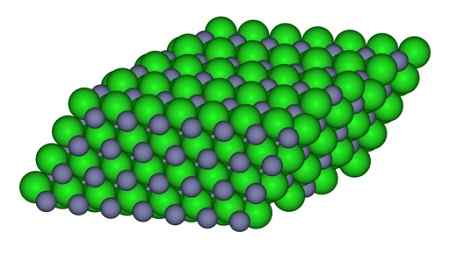 Struttura che forma gli ioni nel cristallo ZnCl2. CCOIL/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons.
Struttura che forma gli ioni nel cristallo ZnCl2. CCOIL/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons. Nomenclatura
- Cloruro di zinco (ii)
- Dicloruro di zinco
Proprietà
Stato fisico
Bianco incolore solido o cristallino. Cristalli esagonali.
Peso molecolare
136,3 g/mol
Punto di fusione
290 ºC
Punto di ebollizione
732 ºC
Densità
2.907 g/cm3 a 25 ° C
Solubilità
Molto solubile in acqua: 432 g/100 g H2O a 25 ° C, 614 g/100 g di H2O 100 ° C. Molto solubile in acido cloridrico (HCl), alcol e glicerolo. Totalmente miscibile.
Può servirti: idrossido di mercurio: struttura, proprietà, usi, rischiph
Le sue soluzioni acquose sono acide. Una soluzione di 6 moli di ZnCl2/L ha un pH di 1,0.
Proprietà chimiche
È un composto igroscopico e delicoscuole, perché a contatto con l'umidità dell'ambiente assorbe molta acqua. In acqua è idrolizzato e ha la tendenza a formare un insolubile di base di ossicloruro di zinco.
Reagisce con ossido di zinco (ZnO) in acqua che genera ossicloruri di zinco che costituiscono un materiale di cemento estremamente duro.
È delicatamente corrosivo verso i metalli.
Non è infiammabile.
Ruolo biologico
Zinco biologicamente è uno degli elementi più importanti. È stato riconosciuto come essenziale per tutti i modi di vivere.
Nel corpo umano lo Zncl2 Zn fornisce, che è essenziale per la sintesi di proteine, colesterolo e grasso. In particolare Cinc è importante per il corretto funzionamento del sistema immunitario.
 Lo zinco Zncl2 È importante per la divisione cellulare negli esseri viventi. Ladyofhats / pubblico di dominio. Fonte: Wikimedia Commons.
Lo zinco Zncl2 È importante per la divisione cellulare negli esseri viventi. Ladyofhats / pubblico di dominio. Fonte: Wikimedia Commons. Sono state identificate più di 25 proteine contenenti zinco e molte di queste sono enzimi, necessarie nella divisione cellulare e nella crescita e per il rilascio di vitamina A dal fegato.
La carenza di Cinc può portare alla crescita della crescita, alla funzione mentale depressa, all'anoressia, alla dermatite, alla diminuzione dell'immunità, alla diarrea e alla scarsa visione notturna, tra le altre condizioni.
Ottenimento
Commercialmente questo composto viene preparato reagendo l'acido cloridrico acquoso con rottami, rifiuti di zinco o con il minerale che lo contiene. In questa reazione c'è anche idrogeno a gas (h2).
Si ottiene il trattamento dello zinco con cloruro di idrogeno a 700 ° C.
Zn + HCl → ZnCl2 + H2↑
Applicazioni
Nei trattamenti terapeutici
È un antibatterico morbido o batteriostatico, quindi viene utilizzato nelle docce vaginali per eliminare i tricomonas o le infezioni da emofilo. Serve anche a trattare i calli, come un astringente e nel chemiocirugia nel cancro della pelle.
È usato come astringente in alcuni cosmetici come le lozioni rinfrescanti per la pelle.
Come integratore nutrizionale
A causa della sua importanza in varie funzioni dell'organismo umano lo ZnCl2 È somministrato per via orale come parte degli accessori nutrizionali e anche nelle persone che richiedono cibo parenterale.
Supplementi ZnCl2 Sono forniti per curare la zona.
Può servirti: miscela omogenea Supplementi ZnCl2 Dovrebbero essere usati quando c'è una carenza di zinco. Autore: Moakets. Fonte: Pixabay.
Supplementi ZnCl2 Dovrebbero essere usati quando c'è una carenza di zinco. Autore: Moakets. Fonte: Pixabay. Le persone sane lo acquisiscono attraverso il cibo.
Dovrebbe essere fornito almeno 1 ora prima dei pasti o 2 ore dopo questi, poiché alcuni alimenti possono impedire il loro assorbimento. Nei pazienti che hanno irritazione allo stomaco dopo l'ingestione integrativa dovrebbero ingerzzarlo con i pasti, ma in questo modo lo zinco sarà meno biodisponsibile.
In applicazioni veterinarie
Le sue soluzioni sono state usate negli animali come agente caustico per bruciare o fare fistole, che sono connessioni tra organi che non sono normali o sani; sotto forma di pasta serve a trattare le ulcere e la chemioterapia del cancro.
 Le soluzioni acquose di ZnCl2 Sono usati per trattare le infezioni degli occhi animali. Autore: Mabel Amber. Fonte: Pixabay.
Le soluzioni acquose di ZnCl2 Sono usati per trattare le infezioni degli occhi animali. Autore: Mabel Amber. Fonte: Pixabay. Nelle infezioni oculari una soluzione molto diluita di questo composto funge da antisettico e astringente.
Viene anche usato come tracce di alimentazione animale o come integratore alimentare.
In cementi speciali
La reazione tra ZnCl2 E lo ZnO in acqua produce un po 'di ossicloruro di zinco che costituisce un materiale estremamente duro o cemento. I componenti principali sono 4Zno • ZnCl2• 5h2O e ZnO • ZnCl2• 2h2O.
Questo tipo di cemento resiste all'attacco di acido o acqua bollente. Tuttavia, il pentaidrato è molto stabile e insolubile ma immutabile, e il diidrato è più solubile e può causare drenaggio liquido.
Per questi motivi questi cementi hanno poche applicazioni.
Come catalizzatore
Serve ad accelerare alcune reazioni di chimica organica. Funge da agente di condensatore. Ad esempio, nelle reazioni aldoliche, nelle reazioni di aminazione e nelle reazioni di aggiunta del ciclo. In alcuni di questi atti come iniziatore radicale.
È un acido Lewis e catalizza le reazioni di diels-alder. Viene anche usato come catalizzatore nelle reazioni di friedel-Craft, per produrre coloranti e coloranti e nella produzione di resine poliestere-politiche.
Di seguito è una reazione in cui interviene questo composto:
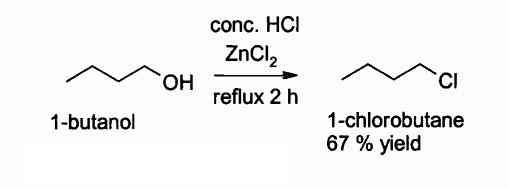 Reazione di ottenere un cloruro alchilico usando ZnCl2. Autore: Walkerma. Fonte: Wikimedia Commons.
Reazione di ottenere un cloruro alchilico usando ZnCl2. Autore: Walkerma. Fonte: Wikimedia Commons. In attività agricole
È stato usato come erbicida nelle colture, come trattamento fogliare, per eliminare i parassiti come funghi e muschio e come micronutriente. È intermediario per preparare i pesticidi.
In applicazioni dentali
Viene utilizzato nei lavaggi della bocca, tuttavia il tempo di contatto raccomandato è molto breve, quindi funge solo da astringente nella mucosa orale. Serve come desensibilizzatore, viene utilizzato nelle paste dentifric e fa parte dei cementi dentali.
Può servirti: clorito di sodio (NaClo2): struttura, proprietà, usi, rischiNel settore tessile e cartaceo
È un ingrediente del solvente che viene utilizzato nella produzione di rayon o seta artificiale dalla cellulosa. È una reticolazione o un agente sindacale per le resine che finiscono sui tessuti. Serve anche a trattarli e favorire la loro conservazione.
Permette di arricciare tessuti, separare le fibre di seta e lana e funge da mordente nella stampa e nella colorazione dei tessuti.
Viene utilizzato nella produzione di rotoli di carta e per produrre carta crepe.
Nella preparazione di nanoparticelle
Reagendo il cloruro di zinco con solfuro di sodio (NA2S) attraverso un metodo sonochimico e in presenza di alcuni composti organici nanoparticelle di solfuro di zinco (ZN) si ottengono. I metodi sonochimici usano le onde sonore per causare reazioni chimiche.
Questo tipo di nanomateriali potrebbe avere l'applicazione come agenti fotocatalitici per produrre, ad esempio, la divisione dell'acqua nei suoi componenti (idrogeno e ossigeno) mediante l'azione della luce.
In diverse applicazioni
- Deodorante, antisettico e disinfettante delle aree. Moss, muffa e funghi Controllo nelle strutture e aree adiacenti esterne come marciapiedi, cortili e recinzioni. Disinfettante di servizi igienici, urinari, tappeti e legno compresso.
- Utilizzato nelle miscele per l'imbaloma e soluzioni per la conservazione dei campioni anatomici.
- Ritardatore di fiamma in legno.
- Ingrediente primario nelle pompe di fumo usate per disperdere una moltitudine di persone; I pompieri li usano negli esercizi e nelle pratiche.
 Il cloruro di Cinc viene utilizzato nelle pompe di fumo utilizzate negli esercizi militari. O.S. Dipartimento della Difesa Currente PhotosCpl. Abraham Lopez / 2a divisione marina / dominio pubblico. Fonte: Wikimedia Commons.
Il cloruro di Cinc viene utilizzato nelle pompe di fumo utilizzate negli esercizi militari. O.S. Dipartimento della Difesa Currente PhotosCpl. Abraham Lopez / 2a divisione marina / dominio pubblico. Fonte: Wikimedia Commons. - Componente di flusso di saldatura. Nella registrazione in metallo. Per colorazione in acciaio, zincato e componente del bagno impiallacciato di ferro con rame.
- In cemento cemento di magnesio e metallo.
- Per rompere le emulsioni nel raffinazione del petrolio. Agente nella produzione di asfalto.
- Elettrolita nelle batterie secche.
 Batteria a secco ZnCl2. Utente: 32 Bitmaschine; A cura dell'utente JayBear/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons.
Batteria a secco ZnCl2. Utente: 32 Bitmaschine; A cura dell'utente JayBear/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons. - Vulcanizzazione della gomma.
- Agente disidratante.
Rischi
Può causare ustioni agli occhi, alla pelle e alle mucose.
Se riscaldato alla sua decomposizione emette cloruro di idrogeno tossico (HCl) e ossido di zinco (ZnO).
Avvertimento sul suo uso come droga
Sebbene mancano studi conclusivi, si stima che se questo composto viene somministrato alle donne in gravidanza, può causare danni al feto. Ma i potenziali benefici potrebbero avere più peso dei possibili rischi.
Riferimenti
- O.S. Biblioteca nazionale di medicina. (2019). Zloruro zinco. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Liska, m. et al. (2019). Cemento speciale. Cemento ossicloruro di zinco. Nella chimica del cemento e in cemento di Lea (quinta edizione). Recuperato da ScienceDirect.
- Pohanish, r.P. (2017). Zloruro zinco. Nel manuale di Sittig di sostanze chimiche e carcinio tossici e pericolosi (settima edizione). Recuperato da ScienceDirect.com.
- Gedanken, a. e Perelshtein, i. (2015). Ecografia di potenza per la produzione di nanomateriali. In potere ultrasonico. Recuperato da ScienceDirect.
- Archibald, s.J. (2003). Gruppi di metallo di transizione 9-12. Reazioni e catalisi. Nella comprensione della chimica del coordinamento II. Recuperato da ScienceDirect.com.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Piombo, d.R. (Editor) (2003). Manuale CRC di chimica e fisica. 85th CRC Press.
- « Struttura del cromato di zinco, proprietà, ottenimento, usi
- Struttura del nitrato di zinco, proprietà, ottenimento, usi »

