Modelli atomici
- 657
- 171
- Silvano Montanari
 I modelli atomici sono le diverse rappresentazioni grafiche che sono state somministrate agli atomi nel corso della storia. Shoppock
I modelli atomici sono le diverse rappresentazioni grafiche che sono state somministrate agli atomi nel corso della storia. Shoppock Cosa sono i modelli atomici?
IL Modelli atomici Sono rappresentazioni grafiche della struttura e del funzionamento di un atomo. Ci sono stati numerosi modelli nel corso della storia.
Questo perché l'idea dell'atomo come un blocco fondamentale di cui è fatta la materia, è nata migliaia di anni fa, nell'antica Grecia. A quel tempo l'atomo era solo un prodotto della speculazione filosofica.
Mentre sono state fatte nuove scoperte scientifiche, sono stati creati nuovi modelli per incorporare le conoscenze acquisite. E così è successo secolo dopo il secolo fino ad oggi, quando la tecnologia ci ha permesso di osservare gli atomi attraverso i microscopi e determinare il modello corretto.
Cosa sono gli atomi?
Gli atomi sono strutture submicroscopiche di cui si forma tutto il soggetto che percepiamo e con cui interagiamo ogni giorno, dal nostro stesso corpo, dal cibo che mangiamo, i vestiti che indossiamo, ai grandi grattacieli e ai velivoli.
Inoltre, il sole, la luna, i pianeti, le stelle e le galassie sono formate con atomi.
Questi sono così piccoli che non possono essere visti con microscopi comuni. Altri sono tenuti a una maggiore potenza, chiamati ultramicroscopi. Tuttavia, gli atomi non sono le unità più piccole della natura.
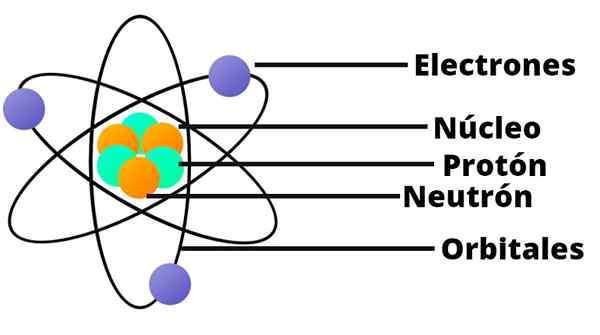
Gli atomi sono formati a loro volta da particelle ancora più piccole: protoni, neutroni ed elettroni.
I protoni hanno una carica elettrica positiva, mentre i neutroni non hanno alcuna carica elettrica. Questi due tipi di particelle formano il nucleo dell'atomo.
Ruotare attorno al nucleo come pianeti intorno al sole sono elettroni, che hanno una carica elettrica negativa.
Modello atomico di Democrito

Democrito di Abdara era un filosofo greco che viveva tra 460 e 370 prima dell'era attuale. Ha affermato che tutta la materia era formata da piccole particelle che chiamava atomi, il che in greco significa indivisibile.
Secondo Democrito, l'atomo è la parte più piccola in cui la questione può essere divisa. Ce n'è un numero infinito, che sono indistruttibili, incredibili, eterni e assolutamente compatti, senza pori. Esistono diversi tipi, che differiscono per forma, grandezza, posizione e il modo in cui sono disposti.
Può servirti: disastri causati dall'essere umano quando si utilizza scienza e tecnologiaLa teoria di Democrito è stata respinta da Aristotele e poi completamente dimenticata fino all'emergere della scienza moderna.
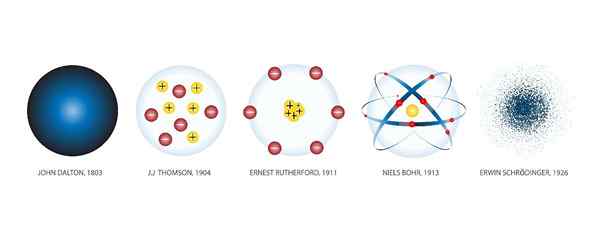
Modello atomico Dalton

John Dalton (1766-1844) era un meteorologo inglese interessato a indagare sulle leggi che governano il comportamento del gas. Il frutto del suo lavoro in quel campo fu il primo modello atomico della scienza moderna, che fece nel 1803.
Poiché l'esistenza di protoni ed elettroni non era ancora stata scoperta, Dalton disse, come Democrito, che l'atomo è la parte più piccola in cui la materia può essere divisa e, quindi, in sé, è indivisibile.
Secondo Dalton, gli atomi sono solidi e hanno una forma sferica, come una palla da baseball. Dalton ha illustrato la sua teoria intagliato in legno, insieme ai suoi assistenti, dozzine di sfere che rappresentavano atomi di diversi elementi chimici.
Questo modello era in vigore fino alla scoperta dell'elettrone.
Modello atomico Thomson
Il fisico inglese Joseph John Thomson (1865-1940) dovette fare una delle scoperte più importanti della scienza moderna: quella dell'elettrone.
Fu nel 1897, nel Cavendish Laboratory dell'Università di Cambridge, in Inghilterra, dove una targa commemora ancora la grande scoperta.
Thompson e i suoi assistenti proiettano un catodo raggi su un campo elettrico. Al contatto con il campo, i raggi si sono deviati formando ampi angoli. Ciò ha confermato che i raggi catodici avevano una carica elettrica negativa. Quelle particelle caricate negativamente le chiamavano elettroni.
Thomson presumeva che gli elettroni fossero incorporati negli atomi. Il suo modello atomico risale al 1904.
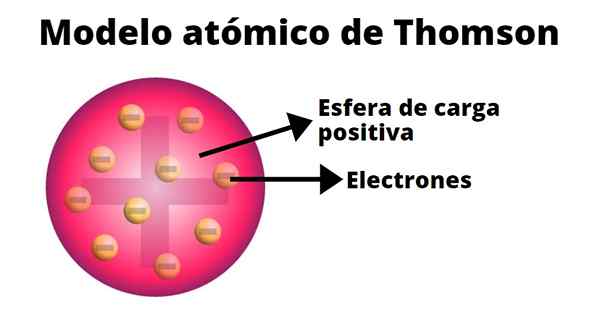
Il budino di uvetta
Nel modello atomico di Thompson l'atomo è una sfera solida con un carico positivo (protoni) su cui i neutroni (carico negativo) sono distribuiti casualmente, poiché l'uvetta lanciata su pudin. Ecco perché questo modello era noto come "Pudin de Pasas".
Secondo Thompson, l'atomo ha un raggio di 0,00000001 centimetri e il suo carico è neutro, poiché i protoni e gli elettroni hanno lo stesso carico, ma di segno opposto.
Il modello Thompson non presenta neutroni.
Modello atomico Rutherford
Ernest Rutherford (1871-1937), un fisico neozileo, era uno degli studenti più importanti di Thomson.
Può servirti: ricerca correlazionaleNel 1911, e basato sull'allora recente scoperta della radioattività, Rutherford ha condotto il seguente esperimento: hanno sparato particelle radioattive alfa di alta velocità ed energia contro un foglio d'oro.
Se il modello atomico Thompson fosse corretto, le particelle alfa passerebbero attraverso il foglio senza deviazione o con una deviazione insignificante. Tuttavia, quando calcolarono l'angolo di deviazione dalle particelle, scoprirono che era ampio e che alcuni persino rimbalzanti contro il foglio dorato.
Con questo risultato Rutherford ha capito che l'atomo dovrebbe avere un nucleo molto piccolo e altamente condensato. Questo nucleo è stato caricato positivamente.
Un piccolo sistema solare
Il modello atomico di Rutherford è come un sistema solare in miniatura. Al centro, nel luogo che corrisponderebbe al sole, c'è il nucleo con i suoi protoni caricati positivamente. Intorno a questo, in orbita come pianeti, ci sono elettroni distribuiti casualmente.
Rutherford ha anche stabilito che la massa dell'atomo è equivalente alla somma delle masse di elettroni e protoni.
Modello atomico Bohr
Sebbene il modello Rutherford fosse un innegabile anticipo rispetto ai modelli precedenti, aveva difetti importanti. Ad esempio, se gli elettroni orbitali attorno al nucleo finirebbero per perdere energia e collassare sul nucleo. Ma questo ovviamente non è successo.
Fu il fisico danese Niels Bohr (1885-1962), uno studente di Rutherford all'Università di Manchester (Inghilterra), che avrebbe proposto nel 1913 un modello atomico che risolse i problemi posti dal suo vecchio professore.
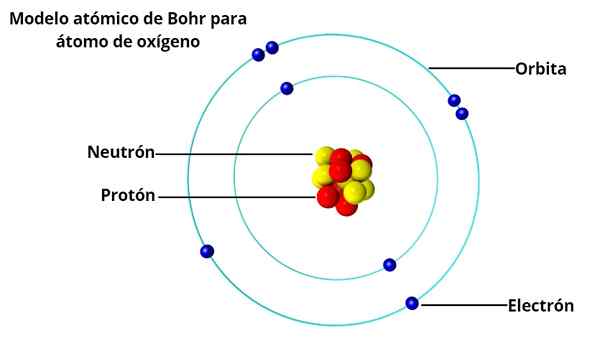
Orbite circolari
Nel modello atomico di Bohr, gli elettroni non orbitano liberamente attorno al nucleo, ma lo fanno in orbite circolari stabili, separate l'una dall'altra da una certa distanza, simile a come sono disposti i pianeti del sistema solare. Ogni orbita è chiamata livello energetico o di energia.
Sulla base delle indagini di Max Planck e Albert Einstein, ha stabilito che ogni elettrone in loro orbita ha una certa quantità di energia.
Mentre orbita in orbita stabile attorno al nucleo, si dice che gli elettroni siano allo stato stazionario. D'altra parte, quando un elettrone "salta" a un'orbita di energia inferiore, c'è un fotone.
Può servirti: metodologiaTuttavia, il modello Bohr non ha avuto successo per spiegare il funzionamento degli atomi con più di un elettrone.
Modello atomico Sommerfeld
Arnold Sommerfeld (1868-1951) era un fisico tedesco che ha dedicato il suo lavoro all'espansione del modello atomico di Bohr. Questo modello esteso è stato presentato nel 1916.
Basato sulla teoria della relatività di Einstein, Sommerfeld ha scoperto che alcuni elettroni orbitano attorno al nucleo a velocità vicino alla luce (300.000 chilometri al secondo).
Ha anche apportato le seguenti modifiche al modello Bohr:
- Gli elettroni si muovono attorno al nucleo in orbite circolari ed ellittiche. Bohr ha riconosciuto solo le orbite circolari.
- All'interno dello stesso livello di energia ci sono sotto -livelli con energie leggermente diverse.
Modello meccanico quantistico (Broglie, Heisenberg e Schrödinger)
Questo è il modello atomico più accurato che è noto ed è attualmente accettato, con alcune aggiunte successive. Fu sviluppato da tre scienziati: il tedesco Werner Heisenberg (1901-1976), l'Austriaco Erwin Schrödinger (1887-1961) e il francese Louis de Broglia (1892-1987).
Questo modello scarta l'idea di elettroni che orbitano il nucleo. Invece, abbiamo nuvole elettroniche, che sono spazi attorno al nucleo in cui è possibile trovare un elettrone. Questo si comporta come un'onda stazionaria.
La probabilità di trovarlo è calcolata con un'equazione stabilita da Schrödinger.
Questo è il modello meccanico quantico dell'atomo che è iniziato dall'equazione di Schrödinger. Con questa equazione potresti conoscere la probabilità di trovare un elettrone in un certo punto di un atomo.
In questo modello ogni elettrone si muove in una direzione specifica, che è determinata da quattro numeri quantici, che sono: numero quantico principale, numero quantico secondario, numero quantico magnetico e rotazione del numero quantico.
Non ci sono due elettroni che possiedono numeri quantici identici, come indicato dal principio di esclusione scoperto dal fisico Wolfgang Pauli.
Riferimenti
- (2010). Atomo. Enciclopedia moderna britannica.
- (S. F.). Modello atomico di Democrito, atomismo filosofico. Preso da energia-nucleare.netto.
- (S. F.). Modello atomico Sommerfeld, espansione al modello Bohr. Preso da energia-nucleare.netto.
- Bertsch, g. F.; Trefil, James e McGrayne, Sharon Bertsch (2021). Atomo. Britannica Enciclopedia. Preso da Britannica.com.
- Duignan, n. (2021). Democrito. Britannica Enciclopedia. Preso da Britannica.com.
- Collaboratori dell'Enciclopedia del Nuovo Mondo. (2021). Atomo. Tratto da Newworldyclopedia.org.
- Zita, Ana. (S. F.). Modelli atomici. Preso dalla Todamateria.com.

