Caratteristiche del modello atomico Thomson, postulati, particelle subatomiche
- 3861
- 807
- Dott. Rodolfo Gatti
Lui Modello atomico Thomson È stato creato dal celebrato fisico inglese j. J. Thomson, che ha scoperto l'elettrone. A causa di questa scoperta e delle sue opere sulla conduzione elettrica nei gas, è stato assegnato nel 1906 con il premio Nobel in fisica.
Dal suo lavoro con i raggi catodici, è stato rivelato che l'atomo non era un'entità indivisibile, poiché Dalton aveva postulato nel modello precedente, ma che conteneva una struttura interna ben definita.

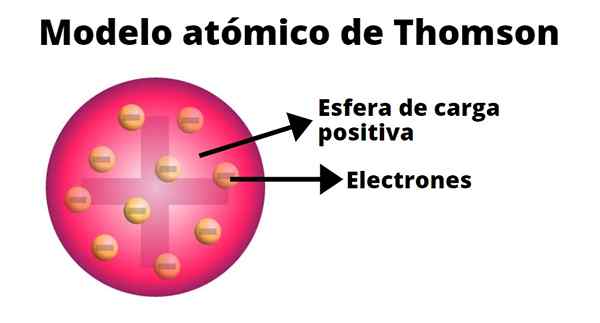
Thomson ha sviluppato un modello Atom basato sui risultati dei suoi esperimenti con i raggi catodici. In lui ha affermato che l'atomo, elettricamente neutro, era formato da cariche positive e negative di uguale grandezza.
[TOC]
Qual era il nome del modello atomico di Thomson e perché?
Secondo Thomson, il carico positivo è stato distribuito in tutto l'atomo e le cariche negative erano incorporate come se fossero l'uvetta di un budino. Da questo confronto è emerso il termine "budino di uvetta", poiché il modello era informalmente noto.
 Joseph John Thomson
Joseph John Thomson Mentre l'idea di Thomson è attualmente abbastanza primitiva, per il suo tempo ha rappresentato un nuovo contributo. Durante la breve validità del modello (dal 1904 al 1910), aveva il sostegno di molti scienziati, sebbene molti altri lo considerassero eresia.
Finalmente nel 1910 emersero nuove prove sulla struttura atomica e il modello di Thomson rimase rapidamente da parte. Ciò è accaduto non appena Rutherford ha pubblicato i risultati dei suoi esperimenti di dispersione, che hanno mostrato l'esistenza del nucleo atomico.
Tuttavia, il modello di Thomson è stato il primo a postulare l'esistenza di particelle subatomiche e i loro risultati sono stati il frutto di una sperimentazione fine e rigorosa. In questo modo ha stabilito il precedente per tutte le scoperte che seguirono.
Caratteristiche e postulati del modello Thomson
Thomson è arrivato al suo modello atomico basato su diverse osservazioni. Il primo è stato che i raggi X appena scoperti da Roentgen sono stati in grado di ionizzare le molecole d'aria. Fino ad allora, l'unico modo per ionizzare era separare chimicamente gli ioni in una soluzione.
Ma il fisico inglese ionizza con successo anche i gas monoatomici come l'elio, attraverso i raggi X. Questo lo ha portato a credere che il carico all'interno dell'atomo potesse essere separato e che quindi non era indivisibile.Ha anche osservato che i raggi catodici potevano essere dirottati da campi elettrici e magnetici.
 J.J. Thomson, scopritore dell'elettrone. Fonte: Lafer.
J.J. Thomson, scopritore dell'elettrone. Fonte: Lafer. Quindi Thomson ha ideato un modello che ha spiegato correttamente il fatto che l'atomo è elettricamente neutro e che i raggi del catodo sono composti da particelle con carico negativo.
Esaminando prove sperimentali, Thomson ha caratterizzato l'atomo come segue:
-L'atomo è una sfera solida elettricamente neutra, con un raggio approssimativo di 10-10 M.
-Il carico positivo è distribuito in modo più o meno uniforme dalla sfera.
-L'atomo contiene "corpuscoli" caricati negativamente, il che garantisce la loro neutralità.
-Questi corpuscoli sono gli stessi per tutta la materia.
-Quando l'atomo è in equilibrio, c'è N Corpuscoli regolarmente disposti in anelli all'interno della sfera di carico positivo.
-La massa dell'atomo è distribuita uniformemente.
Raggi catodici
 Il raggio di elettroni è diretto dal catodo all'anodo.
Il raggio di elettroni è diretto dal catodo all'anodo. Thomson ha condotto i suoi esperimenti usando i raggi catodici, scoperto nel 1859. I raggi catodici sono particelle caricate negativamente. Per produrli, vengono utilizzati tubi di cristallo a vuoto, in cui vengono posizionati due elettrodi, chiamati Catodo E anodo.
Può servirti: magnetismo: proprietà magnetiche dei materiali, usiQuindi viene passata una corrente elettrica che riscalda il catodo, che emette così radiazioni invisibili che viene diretta direttamente all'elettrodo opposto.
Per rilevare le radiazioni, che non è altro che i raggi catodici, la parete del tubo è coperta da un materiale fluorescente. Quando arriva la radiazione, la parete del tubo emana un'intensa luminosità.
Se un oggetto solido viene interposto sul percorso dei raggi catodici, getta un'ombra sulla parete del tubo. Ciò indica che i raggi viaggiano in linea retta e anche che possono facilmente bloccarli.
La natura dei raggi catodici era ampiamente discussa, poiché la sua natura era sconosciuta. Alcuni pensavano che fossero onde elettromagnetiche, mentre altri sostenevano di essere particelle.
Particelle subatomiche di Modello atomico Thomson
Il modello atomico di Thomson è, come abbiamo detto, il primo a postulare l'esistenza di particelle subatomiche. I corpuscoli di Thomson non sono altro che gli elettroni, le particelle fondamentali dell'atomo caricato negativamente.
Attualmente sappiamo che le altre due particelle fondamentali sono il protone, caricato positivamente e il neutrone senza carico.
Ma questi non furono scoperti al momento che Thomson elaborava il suo modello. La carica positiva nell'atomo era distribuita in esso, non considerava alcuna particella che trasportava carico e al momento non c'erano prove della sua esistenza.
Per questo motivo, il suo modello aveva un'esistenza fugace, poiché nel corso di alcuni anni, gli esperimenti di dispersione di Rutherford hanno aperto la strada alla scoperta del protone. E per quanto riguarda il neutrone, lo stesso Rutherford ha proposto la sua esistenza alcuni anni prima di essere finalmente scoperto.
Il tubo di Crookes
Sir William Crookes (1832-1919) progettò il tubo che porta il suo nome intorno al 1870, con l'intenzione di studiare attentamente la natura dei raggi catodici. Ha aggiunto campi elettrici e campi magnetici e ha osservato che i raggi sono stati dirottati da questi.
 Schema del tubo a raggi catodici. Fonte: cavaliere, r.
Schema del tubo a raggi catodici. Fonte: cavaliere, r. In questo modo, Crookes e altri ricercatori, tra cui Thomson, hanno scoperto che:
- Una corrente elettrica è stata generata all'interno del tubo del raggio catodico
- I raggi erano deviati dalla presenza di campi magnetici, allo stesso modo in cui erano le particelle caricate negativamente.
- Qualsiasi metallo usato per produrre il catodo era ugualmente bene per produrre raggi catodici e il loro comportamento era indipendente dal materiale.
Queste osservazioni hanno alimentato la discussione sull'origine dei raggi catodici. Coloro che hanno sostenuto di essere ondate erano basati sul fatto che i raggi del catodo potevano viaggiare in linea retta. Inoltre, questa ipotesi ha spiegato molto bene l'ombra che un oggetto solido interposto ha gettato sulla parete del tubo e in determinate circostanze, si sapeva che le onde potevano causare fluorescenza.
Ma invece non è stato inteso come fosse possibile che i campi magnetici deviassero i raggi del catodo. Ciò aveva una spiegazione solo se questi raggi fossero considerati particelle, un'ipotesi che Thomson condividesse.
Particelle caricate in campi elettrici e magnetici uniformi
Una particella carica di carico Q, sperimenta una forza di fede nel mezzo di un campo elettrico uniforme e, di grandezza:
Può servirti: teoria ondulata della luce: spiegazione, applicazioni, esempiFaith = QE
Quando una particella caricata attraversa perpendicolarmente un campo elettrico uniforme, come quello che si verifica tra due piastre con carichi opposti, sperimenta una deviazione e quindi un'accelerazione:
qe = ma
a = qe/m
D'altra parte, se la particella caricata si muove con velocità V di magnitudo, nel mezzo di un campo magnetico uniforme di grandezza B, la forza magnetica FM che le esperienze hanno la seguente intensità:
Fm = qvb
Finché la velocità e i vettori del campo magnetico sono perpendicolari. Quando una particella caricata colpisce perpendicolarmente in un campo magnetico omogeneo, sperimenta anche una deviazione e il suo movimento è circolare uniforme.
Accelerazione centripeta aC In questo caso è:
QVB = MaC
A sua volta, l'accelerazione centripeta è correlata alla velocità della particella V e al raggio R della traiettoria circolare:
AC = v2/R
Perciò:
QVB = MV2/R
Il raggio della traiettoria circolare potrebbe essere calcolato come segue:
R = mv/qb
Successivamente queste equazioni verranno utilizzate per ricreare il modo in cui Thomson ha dedotto il rapporto carico di elettroni.
L'esperimento di Thomson
Thomson ha superato un raggio di raggi catodici, un raggio di elettroni, sebbene non lo sapesse ancora, attraverso campi elettrici uniformi. Questi campi sono creati tra due piastre conduttive caricate e separate a una piccola distanza.
I raggi del catodo attraversarono anche un campo magnetico uniforme, osservando l'effetto che questo aveva sul raggio. Sia in un campo che nell'altro, c'era una deflessione nei raggi, che portava Thomson a pensare, giustamente, che il raggio fosse composto da particelle cariche.
Per controllare, Thomson ha svolto diverse strategie con i raggi catodici:
- Vary i campi elettrici e magnetici fino a quando le forze non sono state cancellate. In questo modo i raggi catodici sono passati senza sperimentare la deflessione. Forze elettriche e magnetiche abbinate, Thomson è riuscito a determinare la velocità delle particelle di raggio.
- Annullate l'intensità del campo elettrico, in questo modo le particelle seguivano una traiettoria circolare nel mezzo del campo magnetico.
- Combinato i risultati dei passaggi 1 e 2 per determinare il rapporto carico-mandy dei "corpuscoli".
Il rapporto di massa di carico elettronico
Thomson ha stabilito che il rapporto cargo-mandy tra le particelle che costituiva il raggio dei raggi catodici ha il seguente valore:
Q/M = 1.758820 x 10 11 c.kg-1.
Dove Q rappresenta il carico del "corpuscolo", che in realtà è l'elettrone e M È la massa dello stesso. Thomson ha seguito la procedura descritta nella sezione precedente, che ricreiamo qui passo dopo passo, con le equazioni che ha usato.
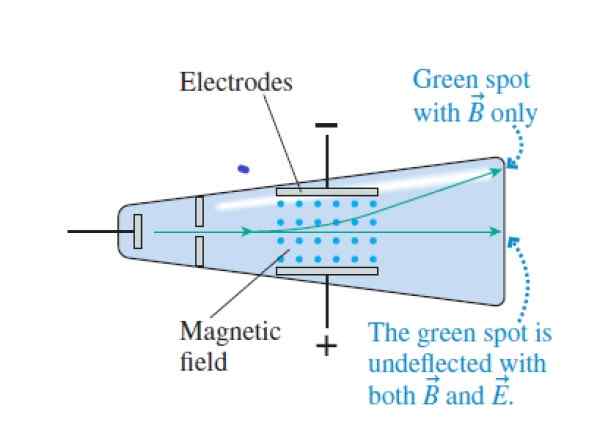 Quando i raggi catodici attraversano i campi croce e magnetici incrociati, passano senza deflessione. Quando il campo elettrico viene annullato, colpiscono la parte superiore del tubo (il campo magnetico è indicato con i punti blu tra gli elettrodi). Fonte: cavaliere, r.
Quando i raggi catodici attraversano i campi croce e magnetici incrociati, passano senza deflessione. Quando il campo elettrico viene annullato, colpiscono la parte superiore del tubo (il campo magnetico è indicato con i punti blu tra gli elettrodi). Fonte: cavaliere, r. Passo 1
Abbina la forza elettrica e la forza magnetica, passando il raggio attraverso i campi elettrici e magnetici perpendicolari:
QVB = QE
Passo 2
Determina la velocità acquisita dalle particelle del raggio quando passano direttamente senza deflessione:
V = e/b
Passaggio 3
Annulla il campo elettrico, lasciando solo il campo magnetico (ora c'è deflessione):
R = mv/qb
Con v = e/b risultati:
R = me/qb2
Il raggio dell'orbita può essere misurato, quindi:
Q/M = V/RB
O Bene:
Q/M = E/RB2
Prossimi passi
La prossima cosa che Thomson fece fu misurare il quoziente Q/M usando catodi realizzati con materiali diversi. Come indicato sopra, tutti i metalli hanno emesso raggi di catodo con caratteristiche identiche.
Può servirti: reattanza induttivaQuindi Thomson ha confrontato i suoi valori con quelli del rapporto Q/M dello ione idrogeno, ottenuto per elettrolisi e il cui valore è circa 1 x 108 C/kg. Il quoziente di carico di elettroni è circa 1750 volte maggiore dello ione idrogeno.
Pertanto i raggi catodici avevano un carico molto maggiore, o forse una massa molto più piccola dello ione idrogeno. Lo ione idrogeno è semplicemente un protone, la cui esistenza era nota tempo dopo gli esperimenti di dispersione di Rutherford.
Oggi è noto che il protone è quasi 1800 volte più massiccio dell'elettrone e con carico di uguale grandezza e segno contrario a quello dell'elettrone.
Un altro dettaglio importante è che con gli esperimenti di Thomson la carica elettrica dell'elettrone non è stata determinata, né il valore della sua massa separatamente. Questi valori furono determinati attraverso gli esperimenti di Millikan, iniziati nel 1906.
Differenze dei modelli Thomson e Dalton
La differenza fondamentale di questi due modelli è che Dalton pensava che l'atomo fosse una sfera. Contrariamente a Thomson, non proponeva l'esistenza di cariche positive o negative. Per Dalton un atomo era così:
 Dalton Atom
Dalton Atom Come abbiamo visto prima, Thomson ha pensato che l'atomo fosse divisibile e la cui struttura è formata da una sfera positiva e da elettroni intorno.
Fallimenti e limitazioni del modello
All'epoca, il modello atomico di Thomson riuscì a spiegare molto bene il comportamento chimico delle sostanze. Ha anche giustamente spiegato i fenomeni che si sono verificati nel tubo dei raggi catodici.
Ma in realtà Thomson non ha nemmeno chiamato le sue particelle di "elettroni", sebbene il termine fosse già stato coniato da George Johnstone Stoney. Thomson li chiamava semplicemente "corpuscoli".
Sebbene Thomson abbia usato tutte le conoscenze che ha avuto per il momento, ci sono diverse importanti limitazioni nel suo modello, che erano evidenti molto presto:
-Il carico positivo non è distribuito in tutto l'atomo. Gli esperimenti di dispersione di Rutherford hanno mostrato che il carico positivo dell'atomo è necessariamente limitato a una piccola regione, che in seguito divenne noto come il nucleo atomico.
-Gli elettroni hanno una distribuzione specifica all'interno di ciascun atomo. Gli elettroni non sono distribuiti uniformemente, come l'uvetta del famoso Buddino, ma hanno una disposizione in orbitali che i modelli successivi hanno mostrato.
È proprio la disposizione degli elettroni all'interno dell'atomo che consente di organizzare gli elementi per le loro caratteristiche e proprietà nella tabella periodica. Questa era una limitazione importante del modello Thomson, che non poteva spiegare come fosse possibile ordinare gli elementi in questo modo.
-Il nucleo atomico è quello che contiene la maggior parte dell'impasto. Il modello di Thomson ha postulato che la massa dell'atomo era uniformemente distribuita all'interno. Ma oggi sappiamo che la massa dell'atomo è praticamente concentrata nei protoni e nei neutroni del nucleo.
È anche importante sottolineare che questo modello atomo non ha permesso di inferire il tipo di movimento che gli elettroni avevano all'interno dell'atomo.
Articoli di interesse
Modello atomico di Schrödinger.
Broglie Atomic Model.
Modello atomico di Chadwick.
Modello atomico Heisenberg.
Modello atomico Perrin.
Modello atomico Dalton.
Modello atomico di Dirac Jordan.
Modello atomico di Democrito.
Modello atomico Leucipo.
Modello atomico Bohr.
Modello atomico Sommerfeld.
Modello atomico attuale.
Riferimenti
- Andriessen, m. 2001. Corso HSC. Fisica 2. Jacaranda HSC Science.
- Arfken, g. 1984. Fisica universitaria. Academic Press.
- Cavaliere, r. 2017. Fisica per scienziati e ingegneria: un approccio strategico. Pearson.
- Rex, a. 2011. Fondamenti di fisica. Pearson.
- Wikipedia. Modello atomico Thomson. Recuperato da: è.Wikipedia.org.
- « Formula generale equazioni quadratiche, esempi, esercizi
- Modello aomico di caratteristiche e postulati di Dirac Jordan »

