Struttura, proprietà, produzione, produzione, usi
- 2624
- 596
- Benedetta Rinaldi
IL Metilamina È un composto organico la cui formula condensata è Cho3NH2. In particolare è la più semplice alchamina primaria di tutte, in quanto contiene solo un sostituente alquilicico, che è lo stesso che dire che esiste un solo legame covalente C-N.
In condizioni normali è un gas di ammoniaca che ha un odore di pesce, ma è relativamente facile da condensare e trasportare nei serbatoi ermetici. Allo stesso modo, può essere disciolto in modo apprezzabile in acqua, causando soluzioni giallastre. D'altra parte, può anche essere trasportato come solido sotto forma di sale di cloridrato, CH3NH2· HCl.
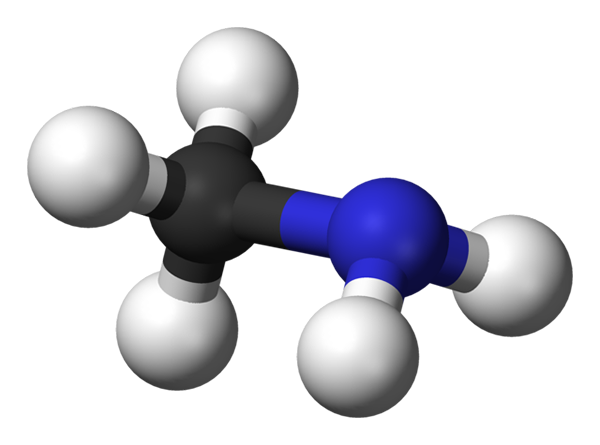
 Molecola di metilamina. Fonte: Benjah-BMM27 via Wikipedia.
Molecola di metilamina. Fonte: Benjah-BMM27 via Wikipedia. La metilamina si verifica industriale da ammoniaca e metanolo, sebbene ci siano molti altri metodi di produzione su scale di laboratorio. Il suo gas è altamente esplosivo, quindi qualsiasi fonte di calore vicino ha il potenziale per causare un grande incendio.
È un composto con alta domanda commerciale, ma allo stesso tempo presenta forti restrizioni legali perché funge da materia prima per droghe e sostanze psicotropiche.
[TOC]
Struttura
L'immagine sopra mostra la struttura molecolare della metilammina rappresentata da un modello di sfere e barre. La sfera nera corrisponde all'atomo di carbonio, al blu all'atomo di azoto e al bianco agli atomi di idrogeno. È quindi una piccola molecola, dove metano, Cho4, Perdere una H per un gruppo NH2, Dare ch3NH2.
La metilamina è una molecola altamente polare, perché l'atomo di azoto attira la densità elettronica del carbonio e gli atomi di idrogeno. Ha la capacità di formare anche ponti idrogeno tra il compendio delle sue forze intermolecolari. Ogni molecola di CH3NH2 Puoi donare o accettare un ponte idrogeno consecutivo (CH3HNH-NH2Cap3).
Può servirti: cos'è la teoria della band?Tuttavia, la sua massa molecolare è considerevolmente bassa, oltre alle porte CH3 Ostacolano tali ponti idrogeno. Il risultato è che la metilammina è un gas in condizioni normali, ma che può essere condensata a una temperatura di -6 ºC. Quando cristallizza, lo fa seguendo una struttura ortorrombica.
Proprietà
Aspetto fisico
Gas colorato o liquido, ma le cui soluzioni acquose possono presentare toni giallastri.
Odore
Spiacevole, simile a quello di una miscela di pesce e ammoniaca.
Massa molare
31.058 g/mol
Punto di fusione
-93.10 ºC
Punto di ebollizione
Intorno al -6 ºC. Pertanto, è un gas che può condensare a temperature non troppo fredde.
Densità
656,2 kg/m3 a 25 ºC. I suoi vapori sono 1,1 volte densi dell'aria, mentre il suo liquido o la condensa è circa 0,89 volte meno denso dell'acqua.
Pressione del vapore
A temperatura ambiente, la pressione del vapore varia da 3,5 atm.
Momento dipolare
1.31 d
Solubilità dell'acqua
1.080 g/L a 20 ºC. È un gas che si dissolve molto bene in acqua, perché entrambe le molecole sono polari e correlate tra loro quando si stabiliscono ponti idrogeno (CH3HNH-OH2).
Basicità
Metilamina ha una costante di basicità (PKB) di 3.36. Questo valore indica che si tratta di una sostanza considerevolmente di base, anche più della stessa ammoniaca, quindi si è dissolto nelle rilasci d'acqua una certa quantità di ioni OH- Quando idrolizzato:
Cap3NH2 + H2O ⇌ ch3NH3+ + OH-
La metilamina è più semplice dell'ammoniaca perché il suo atomo di azoto ha una maggiore densità elettronica. Questo perché Cho3 Fatto più elettroni di azoto rispetto ai tre atomi di idrogeno nella molecola NH3. Anche così, la metiilamina è considerata una base debole di fronte ad altre alchine o ammine.
Può servirti: tipo di collegamento CO2punto d'infiammabilità
-10 ºC a una tazza chiusa, il che significa che è un gas altamente infiammabile e pericoloso.
Temperatura di autorezione
430 ºC
Tensione superficiale
19,15 mn/m a 25 ºC
Decomposizione
Quando brucia viene decomposto termicamente in ossidi di carbonio e azoto, che formano un fumo tossico.
Produzione
La metilamina può essere prodotta o sintetizzata con il metodo commerciale o industriale, o con metodi di laboratorio su scala inferiore.
Industriale
La metilamina si verifica industriale attraverso la reazione che si svolge tra ammoniaca e metanolo su un supporto con gel simpatico catalitico. L'equazione chimica per questa reazione è la seguente:
Cap3Oh + NH3 → Ch3NH2 + H2O
Nel processo possono essere generate altre alcamine; Tuttavia, la metiilamina è il prodotto che sembra più favorito.
Laboratorio
A livello di laboratorio ci sono diversi metodi che consentono di sintetizzare la metilammina su piccola scala. Uno di questi è la reazione in un forte mezzo di base, di KOH, tra acetamide e bromo, durante il quale viene generato il metil isocianato, CH3NCO, che a sua volta viene idrolizzato per diventare metilazione.
La metilamina può essere immagazzinata come un solido se neutralizzato con acido cloridrico, in modo che si forma un sale di cloridrato:
Cap3NH2 + HCl → Ch3NH2· HCl
Quindi, metilammina cloridrato, rappresentata anche come [CH3NH3] Cl, può essere basato su un luogo sicuro per ottenere la soluzione acquosa con gas disciolto:
[Ch3NH3] Cl + NaOH → CH3NH2 + NaCl + H2O
D'altra parte, la metilammina può anche essere sintetizzata dall'esamina (CH2)6N4, che è direttamente idrolizzato con acido cloridrico:
Può servirti: cristallizzazione(Ch2)6N4 + HCl + 6 h2O → 4 NH4CL + 6 CH2O
Consecutivamente, il cloruro di ammonio reagisce con la formaldeide calda per causare vapori di metiilamina e acido formico, hcooh.
Inoltre, la metilammina può essere ottenuta riducendo il nitrometano, CH3NO2 con zinco metallico e acido cloridrico.
Applicazioni
 L'efedrina è un farmaco che necessita di metiilamina per la produzione commerciale. Fonte: Turkeyphant.
L'efedrina è un farmaco che necessita di metiilamina per la produzione commerciale. Fonte: Turkeyphant. La metilamina è un composto i cui usi generalmente generano controversie, in quanto è una sostanza usata nella sintesi dei narcotici come la metanfetamina. In effetti, la sua popolarità è dovuta al desiderio che i protagonisti della serie televisiva di Breaking Bad hanno dovuto ottenerlo ad ogni costo.
Questo composto è anche usato come materia prima per la produzione di insetticidi, farmaci, tensioattivi, esplosivi, coloranti, fungicidi, additivi, ecc., Quindi ha una forte domanda mondiale, oltre a molteplici restrizioni legali per la sua acquisizione.
La sua immensa versatilità chimica è dovuta alla sua molecola CHO3NH2 È un buon agente nucleofilo, collegato o coordinato a substrati di maggiore massa molecolare in diverse reazioni organiche. Ad esempio, questo si basa sulla sintesi dell'efedrina, dove Cho3NH2 Si unisce a una molecola con la conseguente perdita di H.
Riferimenti
- Morrison, r. T. e Boyd, r, n. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Inter-American.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. (10a edizione.). Wiley Plus.
- Wikipedia. (2020). Metilammina. Recuperato da: in.Wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2020). Metilammina. Database PubChem., CID = 6329. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Dylan Matthews. (15 agosto 2013). Ecco cosa "Breaking Bad" fa bene e torto, sull'attività di meth. Recuperato da: WashingtonPost.com
- Prepchem. (2020). Preparazione di metilammina cloridrato. Recuperato da: prepchem.com
- « Proprietà del nitrile, nomenclatura, usi, esempi
- Organizzazione politica degli Aztechi del potere »

