Proprietà del nitrile, nomenclatura, usi, esempi

- 1061
- 294
- Dante Morelli
IL Nitrili Sono tutti quei composti organici che hanno il gruppo funzionale CN, che è anche chiamato un gruppo ciano, o cianuro in termini di chimica inorganica. I nitrili alifatici sono rappresentati con la formula generale RCN, mentre i nitrili aromatici con la formula ARCN.
Sebbene l'idrogeno cianuro, HCN e sali di metallo cianuro siano composti altamente tossici, esattamente lo stesso non accade con i nitrili. Il gruppo CN in uno scheletro di carbonio di qualsiasi tipo (ramificato, lineare, aromatico, ecc.), si comporta in diagonale diverso da un anione cianuro, CN-.
 Formula generale per un nitrile alifatico. Fonte: Benjah-BMM27 via Wikipedia.
Formula generale per un nitrile alifatico. Fonte: Benjah-BMM27 via Wikipedia. I nitrili sono molto diffusi nel mondo della plastica, poiché molti di essi derivano da acrilonitrile, ch2CHCN, un nitrile con cui i polimeri sono sintetizzati come gomme di nitrile, usati per fare chirurgia o guanti da laboratorio. I nitrili sono presenti anche in molti prodotti naturali e farmaceutici.
D'altra parte, i nitrili sono precursori di acidi carbossilici, poiché la loro idrolisi rappresenta un metodo di sintesi alternativo per ottenere quest'ultimo.
[TOC]
Caratteristiche e proprietà
Struttura
Le strutture molecolari dei nitrili variano a seconda dell'identità di R o AR nei composti RCN o ARCN, rispettivamente.
Tuttavia, la geometria del gruppo CN è lineare a causa del suo triplo collegamento, Cé, che è il prodotto dell'ibridazione SP. Pertanto, gli atomi di c-CESS sono situati nella stessa linea. Oltre questi atomi, potrebbe esserci qualsiasi struttura.
Polarità
I nitrili sono composti polari, poiché l'azoto del gruppo CN è molto elettronegativo e attira elettroni verso se stessi. Pertanto, hanno punti di fusione o ebollizione più alti rispetto ai loro omologi.
Può servirti: scandio: storia, proprietà, reazioni, rischi e usiAd esempio, Acetonitrile, Cho3CN, è un liquido che bolle a 82 ºC; Mentre Etano, Ch3Cap3, È un gas che bolle a -89 ºC. Nota il grande effetto che il gruppo CN ha sulle interazioni intermolecolari.
Lo stesso ragionamento si applica ai composti maggiori: se hanno uno o più gruppi CN nella loro struttura, è molto probabile che la loro polarità aumenti e sia più correlata a superfici o liquidi polari.
Basicità
Si potrebbe pensare che a causa dell'elevata polarità dei nitrili, queste sono basi relativamente forti davanti alle ammine. Tuttavia, dobbiamo considerare i legami covalenti CESS e il fatto che sia il carbonio che l'idrogeno hanno ibridazione SP.
La basicità dell'RCN: è rappresentata accettando un protone dall'acqua: acqua:
RCN: + H2O ⇌ rcnh+ + OH-
Per protonare l'RCN: la coppia senza elettroni sull'azoto deve formare un collegamento con lo ione H+. Ma c'è un inconveniente: l'ibridazione dell'azoto lo rende troppo elettronegativo, tanto che questa coppia di elettroni è fortemente attratta e non consente nemmeno a formare un legame.
Pertanto, si dice che la coppia di azoto di azoto non è disponibile e che la basicità dei nitrili sia molto bassa. In effetti i nitrili sono milioni di volte meno basilari delle ammine.
Reattività
Tra le reazioni più rappresentative dei nitrili abbiamo la loro idrolisi e riduzione. Queste idrolisi sono mediate dall'acidità o dalla basicità dell'ambiente acquoso, causando rispettivamente un acido carbossilico o un sale carbossilato:
Può servirti: bilanciamento del vapore liquidoRCN + 2H2O + HCl → RCOOH + NH4Cl
RCN + H2O + NaOH → RCONA + NH3
Nel processo si forma anche un amida.
I nitrili sono ridotti alle ammine usando catalizzatori di idrogeno e metallo:
RCN → RCH2NH2
Nomenclatura
Secondo la nomenclatura di Iupac, i nitrili sono nominati aggiungendo il suffisso -nitrile al nome della catena alcana da cui deriva, incluso anche il carbonio del ciano. Quindi, Cho3CN si chiama Ethanonitrilo e Cho3Cap2Cap2CN, butanonitrile.
Possono anche essere nominati dal nome dell'acido carbossilico, che viene eliminato dalla parola "acido", e i suffissi vengono sostituiti -oic o -oico dal suffisso -onitrile. Ad esempio, per Ch3La CN sarebbe acetonitrile (acido acetico); Per c6H5CN, sarebbe benzonitrile (di acido benzoico); E per lui (Cho3)2CHCN, 2-metilpropanitrile.
In alternativa, se vengono presi in considerazione i nomi dei sostituenti alquilicici, i nitrili possono essere menzionati usando la parola "cianuro". Ad esempio, Cho3CN sarebbe quindi chiamato metil cianuro e (Cho3)2CHCN, isopropil cianuro.
Applicazioni
I nitrili fanno parte di prodotti naturali, essendo in mandorle amare, nelle ossa di vari frutti, in animali marini, piante e batteri.
I suoi gruppi CN costituiscono le strutture di lipidi e glicosidi cianogenici, biomolecole che quando si sono degradate il rilascio di idrogeno cianuro, HCN, un gas altamente velenoso. Pertanto, hanno un uso biologico imminente per alcune creature.
In precedenza si diceva che i gruppi CN danno molta polarità alle molecole e in realtà non passano inosservati quando sono presenti nei composti con attività farmacologica. Tali farmaci in nitrile sono stati usati per combattere l'iperglicemia, il carcinoma mammario, il diabete, la psicosi, la depressione e altri disturbi.
Può servirti: reazione irreversibile: caratteristiche ed esempiIn addition to having a role in biology and medicine, they industrially make up a handful of nitrile plastics, with which surgical and laboratory gloves are made, stamps of automotive parts, hoses and joints due to their resistance against corrosion and fats, Materials such as Tupperware, strumenti musicali o blocchi Legos.
Esempi di nitrile
Successivamente e infine alcuni esempi di nitrili saranno elencati.
Rigori di nitrile
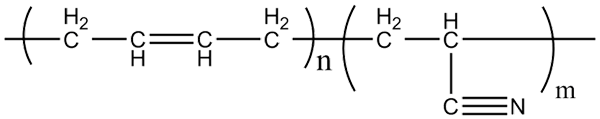 Struttura molecolare dei copolimeri acrilonitrile-butadiene. Fonte: Klever via Wikipedia.
Struttura molecolare dei copolimeri acrilonitrile-butadiene. Fonte: Klever via Wikipedia. La gomma di nitrile, con cui sono fabbricati i guanti di cui sopra e i materiali resistenti al grasso, è un copolimero formato da acrilonitrile e butadiene (sopra). Nota quanto è lineare il gruppo CN.
Ciamemazina
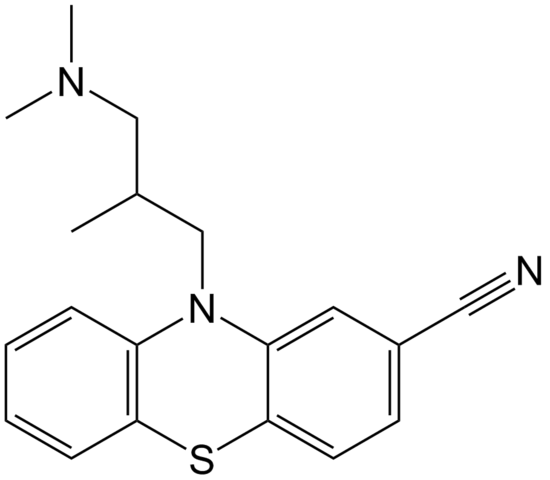 Struttura molecolare della cipemazina. Fonte: dominio EPOP / PUB
Struttura molecolare della cipemazina. Fonte: dominio EPOP / PUB La cyammazina è un esempio di nitrile nell'area della farmacia che viene utilizzato come antipsicotico, in particolare per trattare l'ansia e i disturbi della schizofrenia. Ancora una volta, nota la linearità del gruppo CN.
Citalopram
 Un altro farmaco in nitrile è il citalopram, usato come antidepressivo
Un altro farmaco in nitrile è il citalopram, usato come antidepressivo Amigdalin
 Struttura molecolare della tonsilin. Fonte: Wesalius / Public Domain
Struttura molecolare della tonsilin. Fonte: Wesalius / Public Domain La tonsilla è un esempio di glucóside cianogenica. Si trova in mandorle amare, prugne, albicocche e pesche. Nota quanto sia piccolo il gruppo CN per quanto riguarda il resto della struttura; Anche così, la sua singola presenza è sufficiente per fornire un'identità chimica unica a questo carboidrato.
Riferimenti
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. (10th Edizione.). Wiley Plus.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Morrison e Boyd. (1987). Chimica organica. (Quinta edizione). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Nitrile. Recuperato da: in.Wikipedia.org
- Chimica librettexts. (5 giugno 2019). Chimica dei nitrili. Recuperato da: Chem.Librettexts.org
- Jim Clark. (2016). Nitrili idrolizzanti. Recuperato da: ChemGuide.co.UK
- Ivy Rose olistica. (2020). Naming Nitrile. Estratto da: ivyrose.com
- Germán Fernández. (S.F.). NAMENCLATURA NITRILE: Regole Iupac. Recuperato da: Chemicicaorganica.org
- « Le 8 principali correnti psicologiche e i loro autori
- Struttura, proprietà, produzione, produzione, usi »

