Caratteristiche, struttura, funzioni di Lacasas
- 2537
- 234
- Benedetta Rinaldi
IL le case, P-Dinolo: diossigeno ossidretato o benzenico-ossiduttasi.
Ci sono nelle piante superiori, in alcuni insetti, nei batteri e praticamente tutti i funghi che sono stati studiati; Il suo caratteristico colore blu è un prodotto di quattro atomi di rame attaccati alla molecola nel suo sito catalitico.
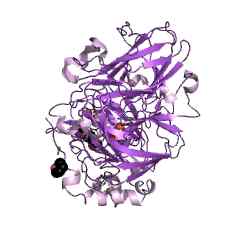
 Rappresentazione grafica della struttura molecolare di un enzima lacasa (Fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Dominio pubblico] tramite Wikimedia Commons)
Rappresentazione grafica della struttura molecolare di un enzima lacasa (Fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Dominio pubblico] tramite Wikimedia Commons) Questi enzimi furono descritti da Yoshida e collaboratori nel 1883, quando studiavano la resina degli alberi Rhus Vernicifera o "albero di lacca" giapponese, dove è stato determinato che la sua funzione principale era catalizzare le reazioni di polimerizzazione e depolerizzazione dei composti.
Molto più tardi è stato scoperto che, nei funghi, queste proteine con attività enzimatica hanno funzioni specifiche nei meccanismi di rimozione dei fenoli tossici dal mezzo in cui crescono, mentre nelle piante sono coinvolte in processi sintetici come la lignificazione.
I progressi scientifici riguardanti lo studio di questi enzimi hanno permesso il loro impiego a livello industriale, dove è stata utilizzata la loro capacità catalitica, specialmente nei contesti di biorisanamento, tessile, nella rimozione dei coloranti applicati ai tessuti, nell'industria cartacea, tra gli altri.
Le ragioni principali per cui Lacasas sono così interessanti dal punto di vista industriale hanno a che fare con il fatto che le loro reazioni di ossidazione implicano semplicemente la riduzione dell'ossigeno molecolare e della produzione di acqua come elemento secondario.
[TOC]
Caratteristiche
Gli enzimi di Lacasas possono essere secreti o essere nella regione intracellulare, ma questo dipende dal corpo che viene studiato. Nonostante ciò, la maggior parte degli enzimi analizzati (ad eccezione di alcune proteine di alcuni funghi e insetti) sono proteine extracellulari.
Può servirti: protobiontesDistribuzione
Questi enzimi, come menzionato sopra, sono prevalentemente nei funghi, nelle piante superiori, nei batteri e in alcune specie di insetti.
Tra le piante in cui è stata dimostrata la loro esistenza ci sono mele, asparagi, patate, pere, mango, pesche, pini, prugne, tra le altre. Gli insetti che esprimono lacasas appartengono principalmente ai generi Bombyx, Callifora, Diploptera, Drosophila, Musca, Papilio, Rhodnius, e altri.
I funghi sono gli organismi di cui sono stati isolati e studiati la più lacca e la varietà di lacasas e questi enzimi sono presenti sia in ascomycetes che deuteromice e basidiomiceti.
Catalisi
La reazione che lacasa catalizza.
Il risultato della reazione catalitica è la riduzione di una molecola di ossigeno in due molecole d'acqua e l'ossidazione, allo stesso tempo, di quattro molecole di substrato per produrre quattro radicali reattivi liberi.
I radicali liberi intermedi possono legare e formare dímeros, oligomeri o polimeri, quindi si dice che Lacasas catalizza le reazioni di polimerizzazione e "depolimerizzazione".
Struttura
I lacasas sono glicoproteine, cioè sono proteine che hanno oligosaccaridi si uniscono covalentemente alla catena del polipeptide, e queste rappresentano tra il 10 e il 50% del peso totale della molecola (sugli enzimi vegetali la percentuale può essere un po 'più alta).
La porzione di carboidrati di questo tipo di proteina contiene monosaccaridi come glucosio, galattosio, fucosa, arabuso e alcune esosamine, e si pensa che la glicosilazione abbia importanti funzioni in secrezione, suscettibilità proteolitica, in attività, ritenzione di rame e stabilità termica della proteina.
Generalmente questi enzimi si trovano in natura come monomeri o omodimisti e il peso molecolare di ciascun monomero può variare tra 60 e 100 kDa.
Il centro catalitico di Lacasas è costituito da quattro atomi di rame (Cu), che concedono alla molecola in generale un colore blu a causa dell'assorbimento elettronico che si svolge nei legami di rame-cobra (Cu-Cu).
Può servirti: allometriaLe lacasi vegetali hanno punti isoelettrici con valori vicini a 9 (abbastanza basilari), mentre gli enzimi fungini sono tra punti isoelettrici di 3 e 7 (quindi sono enzimi che funzionano in condizioni acide).
Isoenzimi
Molti funghi che producono lacasi hanno anche isoforme di questi, che sono codificati dallo stesso gene o da geni diversi. Questi isoenzimi differiscono l'uno dall'altro in termini di stabilità, il loro pH ottimale e la temperatura da catalizzare e in termini di affinità per diversi tipi di substrato.
In determinate condizioni, questi isoenzimi possono avere diverse funzioni fisiologiche, ma ciò dipende dalla specie o dalla condizione in cui è abitato.
Funzioni
Alcuni ricercatori hanno dimostrato che Lacasas è coinvolto nella "sclerotizzazione" della cuticola negli insetti e nell'assemblaggio di spore resistenti alla luce ultravioletta nei microrganismi del genere Bacillo.
Nelle piante
Negli organismi vegetali, Lacasas partecipa alla formazione della parete cellulare, nei processi di lignificazione e "danno" (perdita o disintegrazione della lignina); E inoltre, sono stati correlati alla disintossicazione dei tessuti mediante ossidazione di fenoli antifungini o disattivazione delle fitoexine.
In funghi
Significativamente abbondante in questo gruppo di organismi, Lacasas partecipa a una varietà di processi cellulari e fisiologici. Tra questi, si può menzionare la protezione dei funghi patogeni dei tannini e delle "fitoexine" vegetali; Quindi si può dire che, per i funghi, questi enzimi sono fattori di virulenza.
Lacasas ha anche funzioni nella morfogenesi e differenziazione delle strutture di resistenza e spore di basidiomiceti, nonché nella biodegradazione della lignina in funghi che degradano i tessuti delle specie legnose.
Può servirti: differenze tra scienza e tecnologiaAllo stesso tempo, Lacases partecipa alla formazione di pigmenti del micelio del sistema immunitario di ospiti infetti da funghi patogeni.
Nell'industria
Questi enzimi particolari sono impiegati industrialmente con diversi scopi, ma i più eccezionali corrispondono alle industrie tessili e alle frontiere e ai processi di biorisanamento e decontaminazione del prodotto delle acque reflue di altri processi industriali.
Puntualmente, questi enzimi sono spesso usati per l'ossidazione dei fenoli e i loro derivati presenti in acque contaminate con rifiuti industriali, i cui prodotti di catalisi sono insolubili (polimerizzati) e precipitati, il che li rende facilmente separabili.
Nell'industria alimentare hanno anche una certa importanza poiché la rimozione di composti fenolici è necessaria per la stabilizzazione di bevande come vino, birra e succhi naturali.
Sono usati nel settore cosmetico, nella sintesi chimica di molti composti, nella biorisanamento dei terreni e nella nanobiotecnologia.
I più usati sono Lacasas di funghi, ma recentemente è stato determinato che i lacasas batterici hanno caratteristiche più eccezionali dal punto di vista industriale; Sono in grado di lavorare con la più grande varietà di substrati e a temperature e gamme di pH molto più ampi, oltre ad essere molto più stabili davanti agli agenti inibitori.
Riferimenti
- Claus, h. (2004). LaCaccase: struttura, reazioni, distribuzione. Micron, 35, 93-96.
- Couto, s. R., Luis, J., & Herrera, t. (2006). Applicazioni industriali e biotecnologiche di laccasi: una revisione. Progressi di biotecnologia, 24, 500-513.
- Madhavi, v., & Lele, s. S. (2009). Laccasi: proprietà e applicazioni. Bioresoources, 4(4), 1694-1717.
- Riva, s., Molecolare, r., & Bianco, V. M. (2006). LaCaccase: enzimi blu per chimica verde. Tendenze in biotecnologia, 24(5), 219-226.
- Singh, p., Bindi, c., & Arunika, G. (2017). Laccasi batterica: recente aggiornamento su produzione, proprietà e applicazioni industriali. Biotecnologia, 7(323), 1-20.
- « Cosa sono i vettori di Coplanares? (Con esercizi risolti)
- Caratteristiche della catalasi, struttura, funzioni, patologie »

