Caratteristiche della catalasi, struttura, funzioni, patologie
- 1510
- 422
- Rufo Longo
IL catalasi È un enzima ossidoreduttasi (H2O2: H2O2 ossidorreduttasi) ampiamente distribuito in natura. Catalizza, in vari tessuti e tipi di cellule, la reazione di "decomposizione" del perossido di idrogeno nell'ossigeno molecolare e nell'acqua.
Le prime osservazioni di questo tipo di enzima risalgono ai primi del 1810, ma fu nel 1901 quando Loew riconobbe che la catalasi è praticamente presente in tutti gli organismi viventi esistenti e in più tipi di cellule diverse.
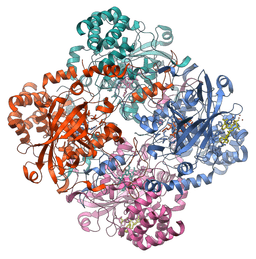
 Struttura molecolare dell'enzima della catalasi (fonte: Vossman [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons)
Struttura molecolare dell'enzima della catalasi (fonte: Vossman [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons) Questo enzima, cruciale per il mantenimento dell'integrità cellulare e il principale regolatore del metabolismo del perossido di idrogeno, è stato un fattore fondamentale per affermare che in natura ci sono enzimi che agiscono su substrati specifici.
I mammiferi e altri organismi hanno enzimi delle catala che possono anche comportarsi come perossidasi, catalizzando le reazioni ossidanti di substrati diversi usando il perossido di idrogeno.
Nella maggior parte degli eucarioti, gli enzimi delle Catala sono preponderanti negli organelli subcellulari noti come "perossisomi" e nell'uomo ci sono numerose condizioni patologiche legate alla carenza di questo enzima.
[TOC]
Caratteristiche
L'attività di enzimi come la catalasi può variare considerevolmente a seconda del tipo di tessuto considerato. Nei mammiferi, ad esempio, l'attività della catalasi è significativa sia nei reni che nel fegato ed è molto più bassa nei tessuti connettivi.
In modo che la catalasi nei mammiferi sia principalmente associata a tutti i tessuti che hanno un significativo metabolismo aerobico.
I mammiferi hanno catala sia nei mitocondri che nei perossisomi e in entrambi i compartimenti sono enzimi associati alle membrane organiche. Negli eritrociti, al contrario, l'attività della catalasi è associata a un enzima solubile (ricorda che gli eritrociti hanno scarsi organelli interni).
Può servirti: mezzo stuart: fondazione, preparazione e usiLa catalasi è un enzima con un numero elevato di sostituzione o catalitica costante (è molto veloce ed efficiente) e la reazione generale che catalizza la seguente:
2H2O2 → 2H2O + O2
In presenza di basse concentrazioni di perossido di idrogeno, la catalasi mammifero, ad esempio, si comporta come un'ossidasi, usando l'ossigeno molecolare (O2) per ossidare molecole come indolo e β-peniletilammina, precursori dell'aminoacido triptofano e un neurotrasmettitore, rispettivamente.
Alcuni inibitori competitivi dell'attività della catalasi sono attualmente noti e tra questi distinguono il sodio e il 3-aminotriazolo azide. Azida, nella sua forma anionica, è un potente inibitore di altre proteine con gruppi di emo e viene utilizzato per l'eliminazione o la prevenzione della crescita del microrganismo in diverse condizioni.
Struttura
Nell'uomo, la catalasi è codificata da un gene da 34 kb che ha 12 introni e 13 esoni e codifica per una proteina di aminoacidi 526.
La maggior parte delle catala studiate sono enzimi tetramerici con un peso molecolare vicino a 240 kDa (60 kDa per ogni subunità) e ogni monomero è associato a un gruppo protesico hemine o ferroprotoporfirina.
La sua struttura è costituita da quattro settori composti da strutture secondarie formate da inferni ALFA e fogli di β, e studi condotti nell'enzima del fegato di esseri umani e bovini hanno dimostrato che queste proteine sono collegate a quattro molecole NADPH.
Queste molecole NADPH non sembrano essenziali per l'attività enzimatica della catalasi (per la produzione di acqua e ossigeno dal perossido di idrogeno), ma sembra correggere una diminuzione della suscettibilità di questo enzima rispetto alle alte concentrazioni del suo substrato tossico.
I domini di ogni subunità nella catalasi degli umani sono:
Può servirti: carotenoidi-Un braccio N-terminale non globulare esteso, che funziona per la stabilizzazione della struttura quaternaria
-Un β-barrel di otto antiparalleli β, che forniscono alcuni dei residui di giunzione laterale al gruppo Hemo
-Un dominio di "avvolgimento" che circonda il dominio esterno, incluso il gruppo Hemo e, infine
-Un dominio con struttura dell'elica alfa
Le quattro subunità, con questi quattro domini, sono responsabili della formazione di un lungo canale la cui dimensione è fondamentale per il meccanismo di riconoscimento del perossido di idrogeno da parte dell'enzima (che utilizza aminoacidi come istidina, asparagine, glutammina e acido aspartico per esso ).
Funzioni
Secondo alcuni autori, la catalasi svolge due funzioni enzimatiche:
-Decomposizione del perossido di idrogeno in acqua e ossigeno molecolare (come perossidasi specifica).
-L'ossidazione dei donatori di protoni, come metanolo, etanolo, molti fenoli e acido formico, usando una mole di perossido di idrogeno (come una perossidasi non specifica).
-Negli eritrociti, la grande quantità di catalasi sembra svolgere un ruolo importante nella protezione dell'emoglobina di fronte agli agenti ossidanti, come perossido di idrogeno, acido ascorbico, metilidrazina e altri.
L'enzima presente in queste cellule è responsabile della difesa di altri tessuti con poca attività della catalasi rispetto alle alte concentrazioni di perossido di idrogeno.
-Alcuni insetti come lo scarabeo del bombardiere usano la catalasi come meccanismo di difesa, poiché il perossido di idrogeno si decompone e usano il prodotto di ossigeno gassoso di detto reazione per spingere la produzione di acqua e altri composti chimici sotto forma di forma.
-Nelle piante, la catalasi (presente anche nei perossisomi) è uno dei componenti del meccanismo di fotospirazione, durante il quale il fosfogliceto prodotto dall'enzima Rubisco viene utilizzato per la produzione di 3-fosfoglicerato.
Può servirti: ciclo di loosPatologie correlate negli esseri umani
Le principali fonti di produzione del substrato catalasi, perossido di idrogeno, sono le reazioni catalizzate da enzimi ossidasi, specie reattive dell'ossigeno e alcune cellule tumorali.
Questo composto è coinvolto nei processi infiammatori, nell'espressione delle molecole adesive, nell'apoptosi, nella regolazione dell'aggregazione piastrinica e nel controllo della proliferazione cellulare.
Quando ci sono carenze di questo enzima, vengono generate alte concentrazioni del suo substrato, che produce lesioni nella membrana cellulare, difetti nel trasporto elettronico nei mitocondri, nel metabolismo dell'omocisteina e nel DNA.
Tra le malattie associate alle mutazioni nel gene codificante per la catalasi degli esseri umani:
-Mellito diabete
-Ipertensione arteriosa
-Alzheimer's
-Vitiligine e altri
Riferimenti
- Agar, n., Sadrzadeh, s., Findo, p., & Eaton, J. (1986). Eritrocita catalasi. Una difesa ossidante somatica? J. Clin. Investire., 77, 319-321.
- Góth, l., Rass, p., & Páy, a. (2004). Mutazioni enzimatiche della catalasi e la loro associazione con i progetti. Diagnosi molecolare, 8(3), 141-149.
- Kirkman, h., & Gaetanit, G. F. (1984). Catalasi: un enzima tetramericano con quattro molecole strettamente legate alla NADPH. Proc. Natl. Acade. Sci. Usi, 81, 4343-4347.
- Kirkman, h. N., & Gaetani, G. F. (2006). Catalasi dei mammiferi: Venerabile enzima con nuovi misteri. Tendenze nelle scienze biochimiche, 32(1), 44-50.
- Rawn, j. D. (1998). Biochimica. Burlington, Massachusetts: Neil Patterson Publishers.
- Salomone, e., Berg, l., & Martin, D. (1999). Biologia (5 ° ed.). Filadelfia, Pennsylvania: Saunders College Publishing.
- Vinshtein, b., Melik-Adamyan, w., Barynin, v., Vagin, a., & Grebenko, a. (1981). Struttura tridimensionale dell'enzima catalasi. Natura, 293(1), 411-412.
- « Caratteristiche, struttura, funzioni di Lacasas
- Caratteristiche di movimento rettilinea uniformemente, formule »

