Inerzia chimica

- 2180
- 357
- Benedetta Rinaldi
Cos'è l'inerzia chimica?
L'inerzia chimica è la proprietà che ha una sostanza o materiale per resistere al degrado causato da agenti esterni. In questo senso le sue proprietà fisiche e, in particolare le sostanze chimiche, rimangono invariate. Non ci sono pause di collegamento o formazione di nuove.
Ora, l'inerzia chimica è relativa. Alcune sostanze o materiali sono più inerti di altri, il che è dovuto alla natura e alla forza delle loro interazioni. Come, in linea di principio, contrastare i fenomeni del cambiamento, indispensabile per la materia da evolversi in vari prodotti.
 Un capolino d'oro. L'oro è corrosione metallo più resistente
Un capolino d'oro. L'oro è corrosione metallo più resistente Ecco perché, per quanto inerte che sia una sostanza o materiale, ci sarà sempre una condizione in cui diventa reattiva. Ad esempio, l'oro è il più nobile dei metalli ed è considerato inerte. Tuttavia, viene attaccato e sciolto dall'acqua reale, una soluzione alla quale è molto reattiva.
Forse, e fino ad oggi, l'unico elemento chimico che ha dimostrato un'inerzia chimica assoluta è il neon. Non è noto nessun composto, nemmeno in condizioni di ultravirico, come quelle nei nuclei dei pianeti o delle lune.
Caratteristiche dell'inerzia chimica
Mancanza di ossidazione
Per essere inerte un materiale o una sostanza, in linea di principio, non dovrebbe reagire con l'aria circostante. Ciò significa che non tende a formare collegamenti con molecole di ossigeno o azoto che circondano la sua superficie. In altre parole: non ossidare l'esposizione all'aria.
Il cibo e tutte le sostanze biologiche in questione tendono ad ossidarsi. Si dice quindi che non siano inerti.
La mancanza di ossidazione nell'inerzia chimica deve essere mantenuta a temperature superiori a 100 ºC. Maggiore è la temperatura, le sostanze o i materiali inizieranno ad ossidarsi più rapidamente, reagendo con l'ossigeno o l'azoto dell'aria per formare ossidi o Nituros, rispettivamente.
Resistenza acida o alcali
Un'altra caratteristica presente nell'inerzia chimica è la resistenza agli acidi o alle basi. Ciò significa che una sostanza o un materiale inerte dovrebbe resistere all'attacco degli acidi, senza tendenza a degradarsi dall'accettazione degli ioni H+ o elettrofili molto forti; o l'attacco delle basi, senza degradare a causa degli ioni OH-.
Può servirti: acido perbromico (HBRO4): proprietà, rischi e usiAncora una volta, questo è relativo, poiché ci sono diversi tipi di acidi e basi. Alcune sostanze inerte possono essere molto resistenti, per esempio, acido solforico, ma sono degradate invece della goccia inferiore dell'acido fluoride. Questo è il caso delle bottiglie di vetro quando reagiscono con HF.
Stabilità elettronica
Le caratteristiche di cui sopra hanno a che fare con la stabilità termodinamica derivata dalla natura delle interazioni intermolecolari, oltre ad altri fattori. D'altra parte, l'inerzia chimica viene anche intravisto nelle caratteristiche elettroniche degli stessi atomi.
Più stabile è la configurazione elettronica di un atomo, minore è la sua tendenza a vincere o perdere elettroni. Pertanto, mostrerà una maggiore inerzia chimica. Questo è il caso di gas nobili, che saranno visti nella prossima sezione.
Bioinattività
In medicina, una sostanza o un materiale è inerte se manca di bioattività. Cioè, può essere situato all'interno di un organismo senza essere assimilato durante il suo metabolismo. Questa funzione è molto desiderabile nelle protesi ossee o nella ricostruzione dei tessuti.
Resistenza alle radiazioni
Infine, anche sostanze o materiali inerti dovrebbero essere resistenti alle radiazioni, essere ultraviolette o nucleari.
Esempi di inerzia chimica
Bicchiere
 Il vetro è un materiale relativamente inerte
Il vetro è un materiale relativamente inerte Tra gli esempi di materiali che presentano inerzia chimica abbiamo il vetro. Se non fossero inerti, non servirebbero per l'elaborazione di contenitori o contenitori, poiché reagirebbero con il loro contenuto. A seconda della loro composizione, come i borosilicati, possono diventare molto resistenti alla corrosione e alla temperatura.
Tuttavia, come menzionato all'inizio, il vetro non è immune a tutte le sostanze: reagisce con l'HF, persino diluito, alcali caldi, come NaOH e H3Po4 Molto concentrato e caldo.
Può servirti: pirolisiPlastica
 Se la padella di Teflon non fosse inerte, rovinerebbe tutti gli alimenti in cui abbiamo cucinato al suo interno. Fonte: Mdevicente, CC0, via Wikimedia Commons
Se la padella di Teflon non fosse inerte, rovinerebbe tutti gli alimenti in cui abbiamo cucinato al suo interno. Fonte: Mdevicente, CC0, via Wikimedia Commons Le materie plastiche svolgono anche funzioni simili a quelle del vetro, ma ci sono molti più versatili (non si rompono così facilmente). Alcune materie plastiche, come il teflon (politetrafluoroetilene), kynar (polivinilidene fluoruro) e telene (polidicciclopentadiene), sono estremamente resistenti all'attacco di acidi e corrosione.
Ceramica
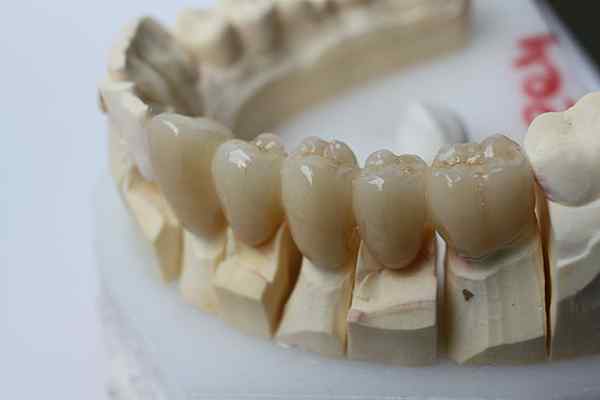 L'inerzia chimica della zirconia consente di essere utilizzato per le protesi dentali. Fonte: bin im garten via wikipedia.
L'inerzia chimica della zirconia consente di essere utilizzato per le protesi dentali. Fonte: bin im garten via wikipedia. Le ceramiche inerte fanno un passo oltre la plastica. Sono destinati a applicazioni in cui predominano le alte temperature, abbastanza abituali nell'industria automobilistica e aerospaziale; o nei sistemi biochimici, come nell'industria farmaceutica e nell'attuazione delle protesi ossee.
Tra alcune di queste ceramiche con grande inerzia chimica che abbiamo: allumina (a2O3, Presenti nel Corindon e nello zaffiro), i silicati (vetro specializzato), il carburo di silicio (sic, duro e tenace) e zirconia (Zio2).
Gas inerti
Lasciando da parte i materiali inerti, ora abbiamo sostanze inerte. I gas inerti non sono molto reattivi, quindi la loro presenza nell'aria non implica alcun rischio di reazione in condizioni normali.
Tra questi gas abbiamo il CO2, Co e n2. L'azoto è il più inerte di tutti questi gas; Eppure, è in grado di reagire caldo con alcuni metalli per formare Nituros, M3NN, essendo N Valencia o stato di ossidazione del metallo.
Il co2 È relativamente inerte; Tranne quando incontra soluzioni alcaline, dove si trasforma in carbonati o in presenza di enzimi anidraici a carbone.
Da parte sua, il CO rimane inerte a temperatura ambiente; Ma ad alte temperature reagisce con carbone, vapore acqueo, ossidi di metallo, olefine, tra gli altri composti.
Può servirti: equilibrio chimico: spiegazione, fattori, tipi, esempiTali reazioni possono procedere in presenza di catalizzatori metallici. Allo stesso modo, CO, anche senza rompere i suoi legami covalenti, è in grado di coordinare gli atomi di metallo neutro.
Metalli nobili
I metalli nobili sono i più resistenti alla corrosione e all'attacco di acidi e alcali. Ciascuno, ad alte temperature, o in formato polvere, reagirà con ossigeno o fluoruro. Pertanto, l'inerzia chimica di questi elementi è piuttosto relativa.
Tra i metalli nobili che abbiamo: oro (AU), Ruthenio (Ru), Platinum (Pt), Paladio (PD), Osmio (OS) e Iridido (IR). Di tutti loro, l'oro è il più nobile, essendo anche in uno stato metallico nella crosta terrestre.
gas nobili
E infine, nella sede più alta dell'inerzia chimica, abbiamo gas nobili: elio (lui), neon (NE), argon (AR), Crypton (KR), Xenon (XE) e Radon (RN). Tutti sono estremamente inerti. Tuttavia, molti composti dello xeno sono stati sintetizzati, compresi i sali noti come perxenatos, con l'anione xeo64-.
 Le luci al neon corrispondono agli elementi chimici più inerti della natura
Le luci al neon corrispondono agli elementi chimici più inerti della natura La sua inerzia chimica è perché i loro atomi contengono la loro energia e strati orbitali totalmente pieni di elettroni. Dall'argon, è possibile che, in Ultrapressions, accederanno agli elettroni usando gli strati orbitali vuoti o più energetici (3D e 4s, ad esempio); cosa impossibile per l'elio o il neon.
Di gas nobili precisamente elio e neon sono i più inerti. L'elio è in grado di formare composti con sodio a pressioni molto elevate (Hena).
Nel frattempo, nessun composto è affatto noto, essendo ancora più inerte dello stesso elio a causa del suo maggiore carico nucleare efficace, che respinge fortemente qualsiasi atomo che cerca di avvicinarsi agli atomi di neon.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Inorgán ChemistryICA. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2020). Chimicamente inerte. Recuperato da: in.Wikipedia.org
- Dottore. Doug Stewart. (2020). Definizione inerte. Recuperato da: Chemicool.com
- Elsevier b.V. (2020). Inerzia chimica. Scienceirect. Estratto da: ScienceDirect.com
- Clara Moskowitz. (20 marzo 2018). Una sorpresa del gas nobile: l'elio può formare strani composti. Recuperato da: scientifico americano.com
- Coorstek. (2020). Proprietà chimiche della ceramica tecnica. Recuperato da: Coorstek.com
- Osborne Industries. (2020). Le 3 materie plastiche più resistenti agli acidi. Recuperato da: Osborneindustries.com

