Ione idronio
- 2600
- 303
- Benedetta Rinaldi
Qual è lo ione idronio?
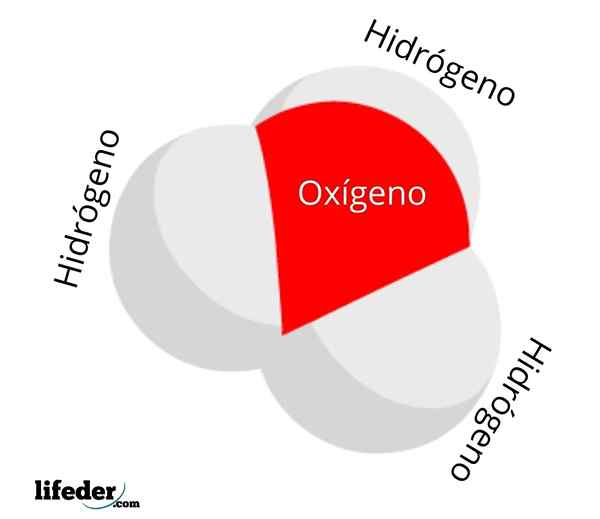
Lui Ione idronio È una specie di carico positivo che deriva dalla protonazione di una molecola d'acqua e la cui formula chimica è h3O+. È costituito dai più semplici degli ossoniani: ioni in cui l'ossigeno ha un carico formale positivo e ha tre legami covalenti.
Il h3O+ È uno dei cationi più semplici ma curiosi che esistono. In acqua in condizioni normali ha una concentrazione di 1 · 10-7 M, prodotto dell'equilibrio di autorizzazione. Tuttavia, la sua concentrazione aumenta esponenzialmente quando è forte3O+ Si dissolvono nell'acqua, acidificandolo.
 Molecola ionica di idronio
Molecola ionica di idronio La concentrazione o l'attività di H3O+ Nell'acqua serve a misurare l'acidità delle soluzioni acquose: pH. Più ioni H3O+ Hay, meno positivo sarà pH e più acido sarà la soluzione in questione. Questa acidità, d'altra parte, risiede nello ione idrogeno, h+, che è spesso confuso con ioni h3O+.
 Formula ione o idronio
Formula ione o idronio Il h+ e la sua straordinaria capacità di trasferire tra i ponti idrogeno delle molecole d'acqua consente l'H3O+ associare formazioni cationiche più complesse; come il catione di Eigen, h9O4+, e il catione di Zundel, H5O2+, e molti altri.
Struttura ionica di idronio
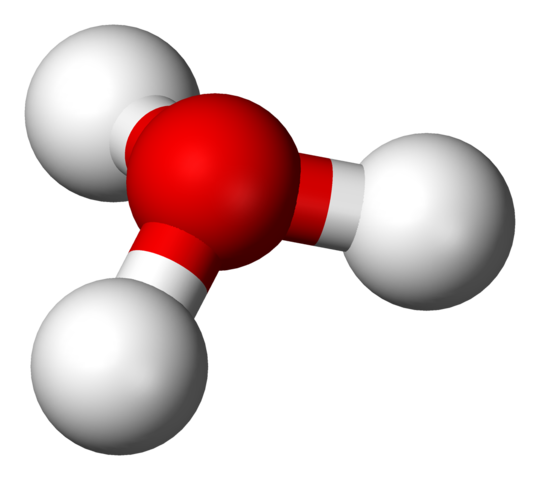 Struttura H3O+ con un modello di sfere e barre
Struttura H3O+ con un modello di sfere e barre Nella prima immagine è possibile vedere la formula strutturale dello ione idro. Ora vediamo la sua rappresentazione con un modello di sfere e barre. In entrambi i punti salienti la geometria della piramide trigonale, i cui angoli di collegamento (O-H) sono 113º; Un po 'deviato da 119º per il tetraedro.
Sebbene l'ossigeno abbia un carico parziale positivo, ciò non significa che la regione negativa sia attorno agli atomi di idrogeno. Anzi. Ossigeno in h3O+ È ancora più prodotto elettronegativo della sua carenza elettronica; Quindi tutta la densità negativa visualizzata su una mappa potenziale elettrostatica:
Può servirti: solfato di potassio (K2SO4): struttura, proprietà, usi, sintesi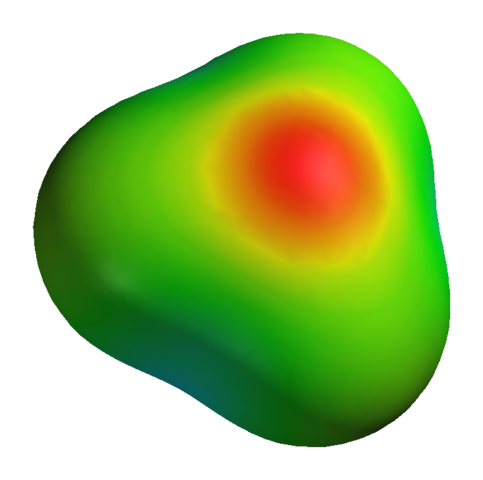 Mappa potenziale elettrostatica per H3O+
Mappa potenziale elettrostatica per H3O+ Per non parlare del fatto che l'ossigeno ha un paio di elettroni liberi, che rafforzano ancora più densità negativa.
Una conseguenza di tutto quanto sopra è che H idrogeni3O+ Perdono la densità elettronica, perché l'ossigeno lo attrae verso se stesso. Pertanto, h3O+ Puoi stabilire fonti di idrogeno molto forti con una molecola d'acqua vicina: H2O+-H-oh2.
Questa interazione è la chiave dietro la straordinaria mobilità ionica di H+ E perché h3O+ È in grado di associarsi a molte molecole d'acqua contemporaneamente.
Acidità
Hydronio Ion è un acido molto forte. In effetti, è l'acido più forte che può esistere in soluzione acquosa. Perché? Perché qualsiasi altro acido più forte di lui protonerà una molecola d'acqua per avere origine h3O+:
Ha + h2O → a- + H3O+
Il h3O+ È in grado di rimanere stabile ogni volta che non ci sono altre basi nell'ambiente più forti dell'acqua. Qualsiasi acido ha rispettato questo sarà classificato come un forte acido. Nel frattempo, se l'acido è più debole di h3O+, Quindi parte di HA non sarà completamente dissociata e parleremo di un acido debole:
Ha + h2O ⇌ a- + H3O+
Pertanto, dal momento che H3O+ È l'acido più forte che esiste nell'acqua, l'acidità di questo dipenderà dalla concentrazione di H3O+. Questa è la base per definire, in termini semplici, l'acidità di una soluzione acquosa espressa come pH:
ph = -log [h3O+"
H+ vs. H3O+
Gli ioni idrogeno e l'idronio non sono gli stessi. Il h+ È molto più acido di h3O+, Bene, consiste in un protone niente di più, che cercherà una molecola per guadagnare elettroni con ogni mezzo. Quando h+ Ottieni una molecola d'acqua forma H3O+:
Può servirti: ossido cupric (CUO)H+ + H2O → h3O+
Ecco perché h3O+ può essere rappresentato come h+(AC), indicando che si tratta di H+ In mezzo acquoso.
La forza di un acido viene misurata nella sua capacità di donare, secondo la definizione di lowry di Brönsted, ioni H+. Quanto è più forte, più donerà+, No h3O+. Gli acidi più forti mai sintetizzati (supercidi) sono quelli in cui h+ È "nudo"; cioè, senza alcun impedimento per saltare verso la molecola che protona.
La pratica di rappresentare H3O+ cenere+(AC) È così comune che ci siano molte volte di entrambi come se fossero uguali, senza che ciò che influisce negativamente sull'interpretazione della chimica delle soluzioni.
Solvatazione
Il h3O+ Può formare ponti idrogeno molto forti con una molecola d'acqua vicina. In tal modo, abbiamo il catione di Zundel, h5O2+:
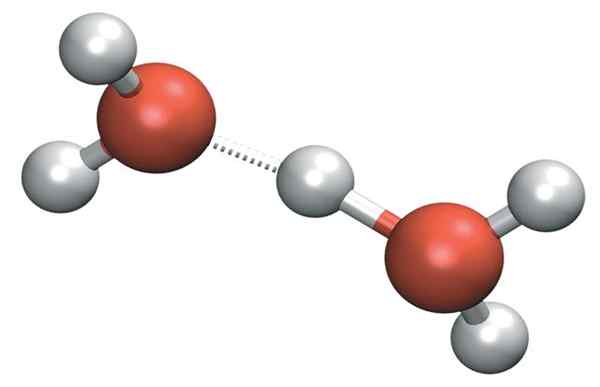 Zundel Cation
Zundel Cation Ma il carico positivo non rimane solo su un singolo lato del catione: questo può essere trasferito all'altra molecola d'acqua come ioni H+:
H2OH-+OH2 → H2O+-H- oh2
Pertanto, il carico positivo è distribuito tra i due atomi di ossigeno per le due molecole d'acqua.
Nel caso del catione di autorizzazione, h9O4+, un h3O+ Formare ponti idrogeno con tre molecole d'acqua, distribuendo tra loro il carico positivo grazie a un "salto" H+. Questi salti sono così veloci, che spiegano la grande mobilità ionica di H+ In acqua, usando H3O+ come veicolo e molecole d'acqua come un'autostrada.
Il h5O2+ e h9O4+ Non sono le uniche associazioni cationiche che h3O+ può avere origine in acqua. Alcuni calcoli della dinamica molecolare dimostrano l'esistenza di un cluster H3O+(H2O)venti: 20 h molecole2O interagire con una H cation3O+ e distribuire tra loro il carico positivo.
Può servirti: neodimio: struttura, proprietà, usiPertanto, h3O+ e h+ Costruiscono una relazione curiosa con molecole d'acqua, oltre l'acidità.
Esci
Proprio come esistono stanze di oxy organiche, non fa eccezione con l'ossia derivata dalla protonazione dell'acqua. La sua formula generale è [h3O+] [X-], Dove x- È un anione che deriva dalla dissoluzione di un acido molto forte.
Questi sali a volte ricevono il nome di "acidi monoidrati", poiché la formula [H3O+] [X-] o h3O+· X- Può anche essere scritto come hx · h2O. Pertanto, possono esserci acidi diidratati, HX · 2h2Oppure, triidrati, hx · 3h2O, ecc.
Ad esempio, HCl può cristallizzare come HCl · H2OH3O+· Cl-. Abbiamo anche altri sali di idronio come H3O+· CLO4- o hclo4· H2Oppure, e HBR · 4H2OH3O+· Br-· 3h2O.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Inorgán ChemistryICA. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2020). Idronio. Recuperato da: in.Wikipedia.org
- Avneet Kahlon e Stephen Lower. (15 agosto 2020). Lo ione idronio. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Helmestine, Anne Marie, PH.D. (25 agosto 2020). Definizione di ioni di idronio. Recuperato da: Thoughtco.com
- I redattori di Enyclopedia Britannica. (2020). Ione idrogeno. Recuperato da: Britannica.com

