Equilibrio di vapore liquido

- 3977
- 721
- Silvano Montanari
Cos'è l'equilibrio del vapore liquido?
Lui Equilibrio di vapore liquido È uno stato dinamico che stabilisce un liquido, che si tratti di una sostanza pura o di una miscela, con il vapore che circonda e interagisce con la sua superficie. Per verificarsi il contenitore deve essere chiuso, altrimenti le correnti d'aria causerebbero evaporare lentamente il liquido.
Quando il sistema è chiuso, la pressione esercitata dalle molecole di fase del vapore si arrampicherà con il passare del tempo. Un punto arriverà in cui la pressione si fermerà; Questa è la pressione di vapore del liquido, che è una proprietà fisica della questione, essendo indipendente dalle dimensioni del contenitore o dal volume del liquido.
 Quando viene scoperta una bevanda a gas, il suo equilibrio di vapore liquido viene disturbato, causando uno squilibrio delle pressioni all'esterno e all'interno della bottiglia, e con esso il bubbo. Fonte: OpenStax, CC di 4.0, via Wikimedia Commons
Quando viene scoperta una bevanda a gas, il suo equilibrio di vapore liquido viene disturbato, causando uno squilibrio delle pressioni all'esterno e all'interno della bottiglia, e con esso il bubbo. Fonte: OpenStax, CC di 4.0, via Wikimedia Commons Ogni liquido, puro o miscelato, avrà una pressione di vapore associata che dipenderà dalla volatilità dei suoi componenti; E quindi, delle forze intermolecolari che le tengono unite all'interno del liquido e sulla loro superficie.
Questa pressione può essere descritta assumendo l'ideità delle soluzioni o la miscibilità dei componenti di una miscela. Per fare ciò, l'uso di diagrammi binari è molto utile, in cui è possibile contemplare la redditività di un processo di separazione.
L'equilibrio del vapore liquido è essenziale per gli infiniti dei processi di ingegneria chimica, come le distillazioni frazionarie e quelle realizzate con vapore acqueo, attraverso i quali si ottengono distillati distillati nei componenti più volatili. Questo è il caso dell'etanolo a 95.4% in acqua, essendo la percentuale di alcol più accessibile ed economica nel mercato.
Sostanze pure
Le molecole di una sostanza pura non sono ancora, ma si spostano da un posto all'altra grazie a un'energia cinetica intrinseca. Questa energia a volte può essere abbastanza grande da superare le forze intermolecolari che "tirano" una molecola da particolare al seno del liquido. Quindi, la molecola fuggerà dalla superficie del liquido alla fase del vapore.
Nella fase del vapore, le molecole si scontreranno con le pareti interne del contenitore, vincendo o perdendo velocità fino a quando non si riuniscono con la superficie del liquido, dove una volta vanno a integrare il conglomerato delle molecole della fase liquida.
Può servirti: cobalto: struttura, proprietà, applicazioniPertanto, il tempo sta andando fino a quando, a una certa temperatura (per dire 25 ° C), il numero di molecole che sfuggono alla superficie è uguale a quelle che entrano dal vapore. Si dice quindi che in una sostanza pura sia stato stabilito un equilibrio a vapore liquido.
La pressione del vapore per sperimentare le pareti interne del contenitore, così come la superficie del liquido, sarà uguale a PAº, che è costante e riproducibile; Indipendentemente da quanto sia grande o piccolo il contenitore né il volume del liquido da considerare.
Miscele
Nelle miscele liquide ci sarà anche un componente che esercita pressione sulla superficie del liquido e sui contorni del contenitore. La pressione del vapore, come prevedibile, sarà composta da contributi da ciascuno dei componenti della miscela, per dire, due sostanze A e B. Queste miscele possono essere miscibili, parzialmente miscibili.
Mistibile
In una miscela miscibile tra A e B, entrambe le sostanze costituiscono una singola fase, che a prima vista sembra una sostanza pura. Pertanto, secondo la legge di Dalton, la pressione della miscela o della soluzione sarà uguale a:
Psole = PA + PB +··· PYo
Essere pYo qualsiasi altro componente presente anche nella miscela. Nota che pA≠ pAº, cioè le pressioni delle sostanze nella miscela non sono le stesse di quelle dei loro stati ad alta purezza.
Quando si assume che la soluzione sia ideale, le differenze tra le interazioni A-A, B-B e A-B sono ovvie. Questo può essere applicato, ad esempio, in una miscela di etanolo e metanolo.
Pertanto, le pressioni del vapore dei componenti nella miscela dipenderanno dalle loro quantità relative nella fase liquida, espresse come frazioni molari xYo. Ed è qui che interviene la legge di Raault, che cerca di mettere in relazione la pressione pA E pAº:
PA = XA PAº
Essendo ora la pressione totale pari a:
Psole = XA PAº + xB PBº +···
La fase del vapore, d'altra parte, avrà le sue composizioni, espresse come frazioni molari yi:
Yi = pYo / Psole
= XYo PYoº / psole
Diagramma binario
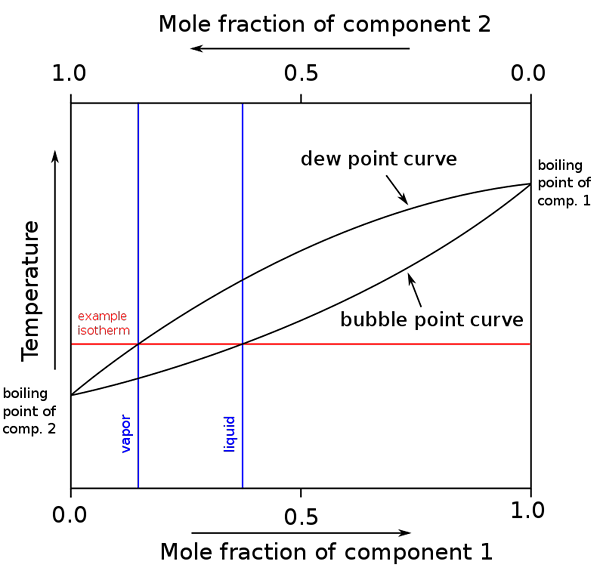 Diagramma di punti di ebollizione e composizioni molari per una miscela binaria. Fonte: binary_boiling_point_diagram.PNG: H padleckasderIvative Work: Michbich, CC BY-SA 2.5, via Wikimedia Commons
Diagramma di punti di ebollizione e composizioni molari per una miscela binaria. Fonte: binary_boiling_point_diagram.PNG: H padleckasderIvative Work: Michbich, CC BY-SA 2.5, via Wikimedia Commons Quando le frazioni molari dei componenti di una miscela binaria (A + B) sono grafiche, a seconda della temperatura o della pressione, si ottengono i diagrammi binari (vedi sopra). Questa forma particolare, la più semplice, corrisponde a quella delle soluzioni ideali.
Può servirti: volume molare: concetto e formula, calcolo ed esempiL'area sopra l '"ovale" corrisponde alla fase del vapore, mentre l'area sottostante corrisponde alla fase liquida della miscela. Si noti che quando la frazione molare del componente 1 o è 0 (x1= 0), la frazione molare del componente 2 o B sarà uguale a 1 (x2= 1), e quindi la pressione del vapore deve solo b. Questa temperatura diventa il punto di ebollizione di B.
Nel frattempo, dall'altra parte (a destra), quando x2= 0 ma x1= 1, la pressione del vapore è solo. Questa temperatura diventa quella del suo punto di ebollizione.
La linea ovale inferiore corrisponde al punto di bolle, che è quando la prima bolla appare quando la miscela liquida viene riscaldata (salire nel diagramma). E la linea superiore corrisponde al punto di rugiada, che è quando la fase del vapore si raffredda e appare la prima goccia (scendendo nel diagramma).
Azeotropos
In molte soluzioni non ideali avremo azeotrops, che sono miscele che evaporano mantenendo costante la loro composizione; cioè, evaporano come se fossero un composto puro.
È impossibile "rompere" una composizione azeotropica attraverso più passaggi di distillazione. Invece, altri metodi vengono utilizzati per aumentare la purezza del componente desiderato.
Ad esempio, la miscela di etanolo-acqua forma un azeotropico con una composizione 95.4 di etanolo. Ciò significa che è impossibile, attraverso le distillazioni, ottenere un etanolo con una concentrazione maggiore di 95.4%; Ce ne saranno sempre 4.6% di acqua rimanente. Se si desidera preparare l'etanolo assoluto (100%), sarebbe necessario utilizzare materiali di disidratazione o altre rotte di sintesi.
In un diagramma binario possiamo vedere la presenza di un azeotrope, che presenta la seguente forma:
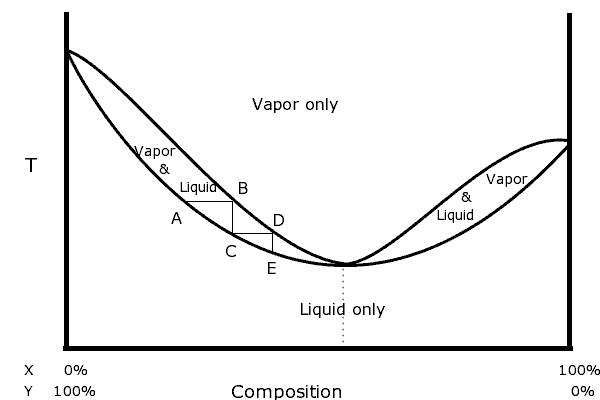 Diagramma binario di una miscela con azeotropico positivo. Fonte: Karlhahn in inglese Wikipedia, dominio pubblico, via Wikimedia Common
Diagramma binario di una miscela con azeotropico positivo. Fonte: Karlhahn in inglese Wikipedia, dominio pubblico, via Wikimedia Common A sinistra del diagramma si può vedere che all'interno dello "ovale", una regione in cui abbiamo l'equilibrio del vapore liquido, possiamo distillare in passaggi consecutivi (a, b, c, d ed e) per ottenere un sempre più ricco ricco Miscela nel componente più volatile (x per questo diagramma).
Nel punto azeotropico, tuttavia, la miscela X e Y e bollire come se fosse una singola sostanza, quindi non importa quante distillazioni sono fatte, sia il liquido che il vapore avranno la stessa composizione.
Può servirti: formula molecolare: come tirarlo fuori, esempi ed eserciziParzialmente miscibile
Nelle miscele parzialmente miscibili verranno formate, a seconda della temperatura, due fasi riconoscibili: una ricca di componente A e un altro ricco di componente B. I diagrammi binari per questi casi sono molti più rigorosi e ampi, poiché coinvolgono regioni in cui il vapore coesiste insieme alle due fasi.
Impossibile
Quando si parla di miscele impossibili, ogni componente si comporterà come se fosse in uno stato di elevata purezza, poiché interagisce a malapena con le altre molecole. Pertanto, la pressione del vapore per queste miscele sarà uguale a:
Psole = PAº + pBº +··· PYoº
La miscela bollirà a una temperatura inferiore a quella dei componenti puri, perché la pressione della miscela impossibile sarà più alta, poiché è uguale alla somma delle pressioni di ciascun componente nel suo stato puro. Una maggiore pressione del vapore implica che è più volatile e quindi bolle a temperatura inferiore.
Applicazioni
Distillazioni
Nelle distillazioni, specialmente a livello industriale, la conoscenza dell'equilibrio del vapore liquido è primaria. Dai componenti della miscela e dei suoi diagrammi di fase, si può calcolare quanti piatti sono necessari nella costruzione di una torre di frazionamento per la corretta separazione di tali componenti.
Distillazione del vapore acqueo
Il vapore acqueo può essere pompato all'interno di una miscela sotto distillazione. Quando il vapore acqueo gorgogliante all'interno del liquido, la pressione del vapore della miscela verrà aumentata, quindi bolle a una temperatura più bassa e contribuirà a estrarre i componenti più volatili (come le essenze).
Bere uccello
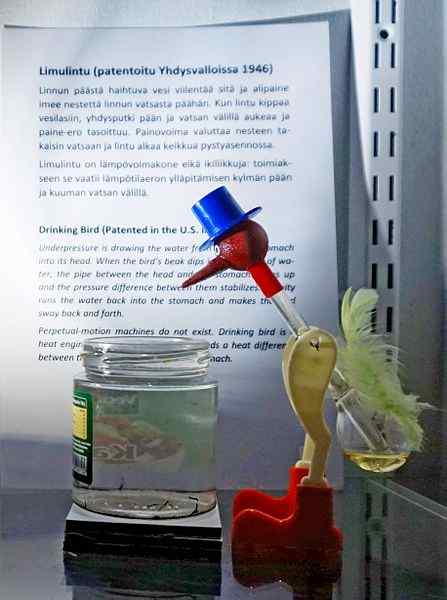 Bere un uccello, uno dei giocattoli più ingegnosi di tutti i tempi. Fonte: Tiia Monto, CC BY-SA 4.0, via Wikimedia Commons
Bere un uccello, uno dei giocattoli più ingegnosi di tutti i tempi. Fonte: Tiia Monto, CC BY-SA 4.0, via Wikimedia Commons Sebbene non sia proprio un equilibrio di vapore liquido, la verità è che dietro il funzionamento dell'uccello bevitore diversi fenomeni termodinamici sono nascosti.
Quando la testa dell'uccello è bagnata, inizia a raffreddare mentre l'acqua evapora. Questa diminuzione della temperatura provoca una diminuzione della pressione all'interno della testa dell'uccello. Il cloruro di metilene, situato alla base dell'uccello, cercherà di bilanciare le pressioni, scorrendo attraverso un tubo di vetro che collega la testa con la testa.
Il liquido si alzerà alla testa dell'uccello, rendendolo più pesante e inclinando il suo corpo in avanti. L'uccello quindi "bere acqua" e le pressioni a vapore si bilancerà. Bilancia le pressioni, l'uccello dell'uccello tornerà in posizione verticale e il ciclo verrà ripetuto mentre l'acqua della testa evapora di nuovo.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Walter J. Moore. (1962). Chimica fisica. (Quarta edizione). Longmans.
- Wikipedia. (2020). Equilibrio vapore-liquido. Recuperato da: in.Wikipedia.org
- Ed Vitz et al. (5 novembre 2020). Equilibrio vapore-liquido. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Limer Eric. (30 gennaio 2018). Una spiegazione assurdamente dettagliata del giocattolo per uccelli bevi. Recuperato da: meccanica popolare.com
- Università di Alicante. (S.F.). Argomento 4: Calcolo del bilanciamento. Diagrammi di equilibrio. [PDF]. Recuperato da: Rua.Ua.È

