Deuterio
- 1390
- 156
- Silvano Montanari
Cos'è il deuterio?
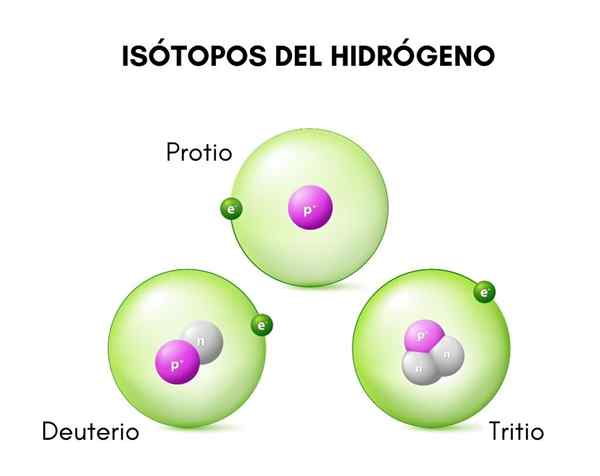
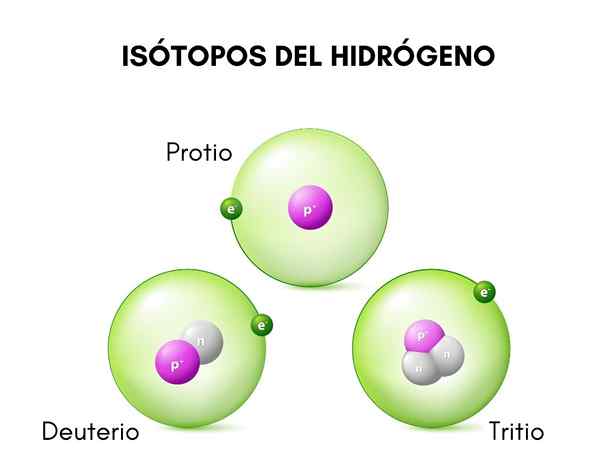
Lui deuterio È una delle specie isotopiche di idrogeno, che è rappresentata come d o 2H. Inoltre, è stato somministrato il nome di idrogeno pesante, perché la sua massa è il doppio di quella del protone. Un isotopo è una specie che proviene dallo stesso elemento chimico, ma il cui numero di massa è diverso da questo.
Questa distinzione è dovuta alla differenza nel numero di neutroni che ha. Il deuterio è considerato un isotopo stabile e può essere trovato nei composti formati dall'idrogeno di origine naturale, sebbene in una proporzione abbastanza piccola (meno dello 0,02 %).
Date le sue proprietà, molto simili a quelle dell'idrogeno ordinario, può sostituire l'idrogeno in tutte le reazioni a cui partecipa, diventando sostanze equivalenti.
Per questo e altri motivi, questo isotopo ha molte applicazioni in diverse aree scientifiche, diventando una delle più importanti.
Struttura del deuterio
La struttura del deuterio è costituita principalmente da un nucleo che ha un protone e un neutrone, con un peso atomico o una massa di circa 2.014 g.
Allo stesso modo, questo isotopo deve la sua scoperta a Harold C. Urey, un chimico degli Stati Uniti, e i suoi collaboratori Ferdinand Brickwedde e George Murphy, nel 1931.

Nell'immagine superiore è possibile vedere il confronto tra le strutture degli isotopi dell'idrogeno, che esiste in forma di Protio (il suo isotopo più abbondante), Deuterio e Trizio, ordinato da sinistra a destra.
La preparazione del deuterio nel suo stato puro è stata effettuata con successo per la prima volta nel 1933, ma dagli anni '50 è stata utilizzata una sostanza in fase solida e questo ha dimostrato stabilità, chiamata deuteride al litio (coperchio), per sostituire il deuterium e il trizio in Un gran numero di reazioni chimiche.
Può servirti: ossido di cloro (iii): proprietà, struttura, usiIn questo senso, l'abbondanza di questo isotopo è stata studiata ed è stato osservato che la sua proporzione nell'acqua può variare leggermente, a seconda della fonte da cui viene prelevato il campione.
Inoltre, attraverso studi di spettroscopia è stata determinata l'esistenza di questo isotopo su altri pianeti di questa galassia.
Alcuni dati sul deuterio
La differenza fondamentale tra gli isotopi dell'idrogeno (che sono gli unici che sono stati nominati in modi diversi) sta nella loro struttura, perché la quantità di protoni e neutroni di una specie conferisce le sue proprietà chimiche.
D'altra parte, l'attuale deuterio all'interno dei corpi stellari viene eliminato con una velocità maggiore di quanto sia originato.
Inoltre, si ritiene che altri fenomeni della natura ne formino solo una quantità molto piccola, quindi la sua produzione continua a generare interesse oggi.
Allo stesso modo, una serie di indagini ha rivelato che la stragrande maggioranza degli atomi che si sono formati da questa specie ha avuto origine nel Big Bang; Questo è il motivo per cui è avvertita la sua presenza su grandi pianeti come Giove.
Poiché il modo più comune per raggiungere questa specie in natura è quando è combinato con l'idrogeno sotto forma di Prouti, l'interesse della comunità scientifica è ancora risvegliato dalla relazione stabilita tra la proporzione di entrambe le specie in diversi campi delle scienze, come come astronomia o tempo.
Può servirti: Renio: scoperta, proprietà, struttura, usiProprietà del deuterio
- È un isotopo privo di caratteristiche radioattive; cioè, è abbastanza stabile in natura.
- Può essere usato per sostituire l'atomo di idrogeno nelle reazioni chimiche.
- Questa specie manifesta un comportamento diverso dall'idrogeno ordinario nelle reazioni biochimiche.
- Quando i due atomi di idrogeno vengono sostituiti nell'acqua, si ottiene D2O, acquisire il nome di acqua pesante.
- L'idrogeno presente nell'oceano che si trova nella forma del deuterio esiste in una proporzione dello 0,016 % in relazione al Proo.
- Nelle stelle, questo isotopo ha la tendenza a fondersi rapidamente per dare origine all'elio.
- Il d2O costituisce una specie tossica, sebbene le sue proprietà chimiche siano molto simili a quelle di H2
- Quando gli atomi di deuterio sono soggetti al processo di fusione nucleare ad alte temperature, si ottiene il distacco di grandi quantità di energia.
- Proprietà fisiche come punto di ebollizione, densità, calore di vaporizzazione, triplo punto, tra gli altri, hanno grandi magnitudini nelle molecole di deuterio (D2) quello in idrogeno (h2).
- Il modo più comune in cui si trova è collegato a un atomo di idrogeno, causando deuteride idrogeno (HD).
Usi/applicazioni
A causa delle sue proprietà, il deuterio viene utilizzato in un'ampia varietà di applicazioni in cui è coinvolto l'idrogeno. Alcuni di questi usi sono descritti di seguito:
- Nel campo della biochimica viene utilizzato nella marcatura isotopica, che consiste nella "marcatura" di un campione con l'isotopo selezionato per seguirlo attraverso il suo passaggio attraverso un determinato sistema.
Può servirti: acido forte- Nei reattori nucleari che eseguono reazioni di fusione, viene utilizzato per ridurre la velocità con cui i neutroni si muovono senza l'elevato assorbimento di questi che presenta l'idrogeno ordinario.
- Nell'area della risonanza magnetica nucleare (NMR), i solventi basati sul deuterio vengono utilizzati per ottenere campioni di questo tipo di spettroscopia senza la presenza di interferenze prodotte mediante solventi idrogenati.
- Nel campo della biologia, le macromolecole sono studiate attraverso tecniche di dispersione dei neutroni, in cui i campioni forniti con deuterio sono usati per ridurre significativamente il rumore in queste proprietà di contrasto.
- Nell'area di farmacologia, la sostituzione dell'idrogeno viene utilizzata dal deuterio con l'effetto isotopico cinetico che viene generato e consente a questi farmaci di avere una mezza vita più lunga.