Tritio
- 4249
- 1138
- Rufo Longo
Qual è il trizio?
Lui Tritio È il nome che è stato concesso a uno degli isotopi dell'elemento chimico idrogeno, il cui simbolo è di solito t o 3H, sebbene sia anche chiamato idrogeno-3. Questo è ampiamente utilizzato in un gran numero di applicazioni, specialmente nel campo nucleare.
Inoltre, negli anni '30 questo isotopo ha avuto origine per la prima volta, basato sul bombardamento con particelle ad alta energia (chiamate deuteroni) di un altro isotopo dello stesso elemento chiamato Deuterio, grazie agli scienziati P. Harteck, m. L. Oliphant ed E. Rutherford.
Questi ricercatori non hanno avuto successo nell'isolamento del trizio nonostante i loro saggi, che hanno mostrato risultati concreti nelle mani di Cornog e Álvarez, scoprendo a sua volta le qualità radioattive di questa sostanza.
Su questo pianeta, la produzione di tritium è di natura estremamente rara, originata solo in proporzioni così piccole che le tracce sono considerate attraverso interazioni atmosferiche con radiazione cosmica.
Struttura Tritio
Quando si parla della struttura del trizio, la prima cosa che si dovrebbe notare è il suo nucleo, il possessore di due neutroni e un singolo protone, il che gli dà una massa tre volte maggiore di quella dell'idrogeno ordinario.
Questo isotopico ha proprietà fisiche e chimiche che lo distingue dalle altre specie isotopiche dall'idrogeno, nonostante le sue somiglianze strutturali.
Oltre ad avere un peso atomico o una massa di circa 3 g, questa sostanza di radioattività, le cui caratteristiche cinetiche mostrano una mezza vita di circa 12,3 anni.

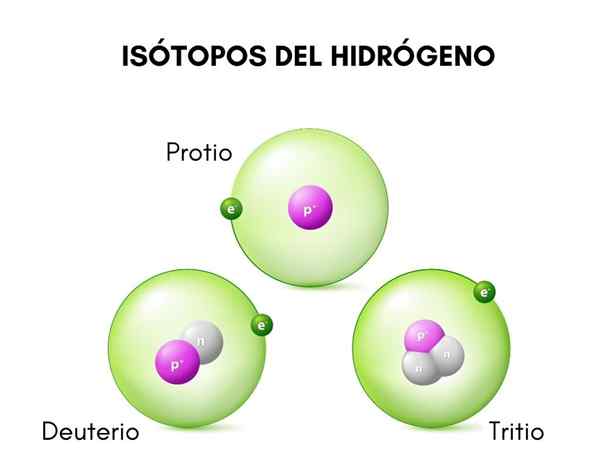
Nell'immagine superiore vengono confrontate le strutture dei tre isotopi noti di idrogeno, chiamati protesi (la specie di maggiore abbondanza), deuterio e trizio.
Può servirti: crociera per crogiolo: caratteristiche, funzioni, usa esempiLe caratteristiche strutturali del trizio consentono di coesistere con idrogeno e deuterio nell'acqua che derivano dalla natura, la cui produzione è probabilmente dovuta all'interazione tra radiazione cosmica e azoto di origine atmosferica.
In questo senso, questa sostanza è presentata nell'acqua di origine naturale in una proporzione di 10-18 in relazione all'idrogeno ordinario; cioè un'abbondanza molto piccola che può essere riconosciuta solo come tracce.
Alcuni dati sul trizio
Diversi modi di produrre Tritio sono stati studiati e utilizzati a causa del loro elevato interesse scientifico per le proprietà radioattive e di uso energetico che presenta.
In questo modo, la seguente equazione mostra la reazione generale con cui si verifica questo isotopo, dal bombardamento di atomi di deuterio con deuteroni ad alta energia:
D + d → t + h
Può anche essere effettuato come una reazione esotermica o endotermica attraverso un processo chiamato attivazione di neutroni di alcuni elementi (come il litio o il boro) e a seconda dell'elemento che viene trattato.
Oltre a questi metodi, Tritio può raro dalla fissione nucleare, che consiste nella divisione del nucleo di un atomo considerato pesante (in questo caso, isotopi di uranio o plutonio) per ottenere due o più nuclei di dimensioni minori, producendo enormi quantità di energia.
In questo caso, ottenere Tritio è somministrato come un prodotto collaterale o per prodotto, ma non è lo scopo di questo meccanismo.
Con l'eccezione del processo precedentemente descritto, tutti questi processi di produzione di questa specie isotopica vengono eseguiti nei reattori nucleari, in cui le condizioni di ciascuna reazione sono controllate.
Può servirti: vetro pyrexProprietà Tritio
- Produce un'enorme quantità di energia quando proviene dal deuterio.
- Presenta le proprietà della radioattività, che continua a suscitare interesse scientifico nella ricerca sulla fusione nucleare.
- Questo isotopo è rappresentato nella sua forma molecolare come t2 O 3H2, il cui peso molecolare è di circa 6 g.
- Simile al protio e al deuterio, questa sostanza ha difficoltà a essere limitata.
- Quando questa specie è combinata con ossigeno, ha origine un ossido (rappresentato come T2O) che è in una fase liquida ed è comunemente noto come acqua superpesada.
- È in grado di sperimentare la fusione con altre specie leggere più facilmente di quella mostrata dall'idrogeno ordinario.
- Presenta un pericolo per l'ambiente se viene utilizzato in modo massiccio, specialmente nelle reazioni dei processi di fusione.
- Può formarsi con ossigeno un'altra sostanza nota come acqua semi -perpetrata (rappresentata come HTO), che è anche radioattivo.
- È considerato un generatore di particelle a bassa energia, noto come radiazione beta.
- Quando sono stati presentati casi di consumo di acqua schiacciata, è stato osservato che la sua mezza vita nel corpo è mantenuta nell'intervallo da 2,4 a 18 giorni, successivamente escreti.
Usi/applicazioni
Tra le applicazioni del trizio ci sono i processi relativi alle reazioni di tipo nucleare. Quindi viene mostrato un elenco con i suoi usi più importanti:
- Nell'area della radioluminescenza, il trizio viene utilizzato per produrre strumenti che consentono l'illuminazione, in particolare i dispositivi notturni, in diversi dispositivi di uso commerciale come orologi, coltelli, armi da fuoco, tra gli altri.
Può servirti: cerio ossido (IV): struttura, proprietà, usi- Nel campo della chimica nucleare, le reazioni di questo tipo sono utilizzate come fonte di energia nella produzione di armi nucleari e termonucleari, oltre ad essere utilizzate in combinazione con il deuterio per i processi di fusione nucleare sotto controllo.
- Nell'area della chimica analitica questo isotopo può essere utilizzato nel processo di marcatura radioattiva, in cui Tritio è collocato in una specie o molecola specifica e puoi monitorare gli studi che si desidera praticare su questo.
- Nel caso dell'ambiente biologico, il trizio viene utilizzato come tracciante di transizione nei processi oceanici, che consente di indagare sull'evoluzione degli oceani sulla terra nelle sfere fisiche, chimiche e persino biologiche.
- Tra le altre applicazioni, questa specie è stata utilizzata per la produzione di una batteria atomica per produrre elettricità.

