Calore di evaporazione

- 4211
- 1012
- Benedetta Rinaldi
 Il calore di evaporazione, o vaporizzazione, è quello che soffre di una sostanza chimica per cambiare lo stato liquido in gassoso
Il calore di evaporazione, o vaporizzazione, è quello che soffre di una sostanza chimica per cambiare lo stato liquido in gassoso Cos'è il calore di evaporazione?
Lui Calore di evaporazione, Chiamato anche calore di vaporizzazione, è definito come la quantità di calore che una chimica pura assorbe per evaporare, cioè subire un cambio di stato dallo stato liquido allo stato del gas.
Cioè, è il calore associato al prossimo processo di cambio di fase:
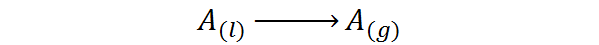
È un tipo di calore che non genera un aumento della temperatura, ma rompe le forze che tengono insieme le molecole liquide. In questo modo, è possibile separare le molecole l'una dall'altra, liberandole alla fase gassosa.
Formula e unità
Il calore di evaporazione o vaporizzazione può essere rappresentato per mezzo del simbolo qVAP. È una quantità estesa, cioè dipende dalla quantità di sostanza.
In questo senso, può essere calcolato dalla quantità di sostanza e da una misura intensiva del calore di evaporazione.
Quando la quantità di sostanza è espressa sotto forma di una massa, dovrebbe essere utilizzato il calore latente di evaporazione o vaporizzazione, lVAP, nel qual caso il calore dell'evaporazione è espresso come:
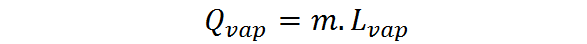
Il calore latente della vaporizzazione è una quantità intensa e caratteristica di ciascuna sostanza. È una misura più o meno diretta di quanto siano forti le interazioni intermolecolari tra le particelle che costituiscono un liquido.
D'altra parte, il calore della vaporizzazione può anche essere calcolato dal numero di moli, nel qual caso è necessario il calore molare di vaporizzazione, chiamato anche entalpia di vaporizzazione:
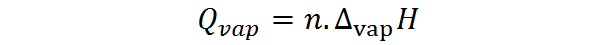
Dove N rappresenta il numero di moli e ∆VAPH è l'entalpia di vaporizzazione della sostanza. L'entalpia di vaporizzazione rappresenta la quantità di pressione costante necessaria per evaporare una moli di sostanza.
Può servirti: acido propanoUnità di calore di evaporazione
Essendo un tipo di calore, che è una forma di energia, il calore di evaporazione è espresso in unità energetiche. Le unità più comunemente usate sono:
- Calorie (lime)
- Kilocalories (kcal o lime)
- Jouls o joules (j)
- Kilojouls o Kilojulios (KJ), ecc.
D'altra parte, il calore latente dell'evaporazione (LVAP) È espresso in unità di energia di massa. Per esempio:
- lime/g
- Kcal/g
- Kcal/kg
- KJ/g
- KJ/kg, ecc.
Infine, entalpia di vaporizzazione (∆VAPH) È espresso in unità energetiche su unità di quantità di materia, di solito talpe. Alcuni esempi sono:
- calce/mol
- Kcal/mol
- J/mol
- KJ/mol, ecc.
Come viene calcolato il calore dell'evaporazione?
Come abbiamo visto un momento fa, il calore di evaporazione può essere calcolato dalla massa o dal numero di moli e dal calore latente di evaporazione o dall'entalpia di vaporizzazione, rispettivamente.
Tuttavia, questi importi vengono generalmente determinati con sperimentazione sperimentalmente la quantità di calore necessaria per evaporare una certa massa di una sostanza e quindi eliminare una delle due equazioni precedenti.
A causa di quanto sopra, la cosa comune non è che il calore della vaporizzazione sia calcolato, ma che sia misurato sperimentalmente, in laboratorio.
D'altra parte, poiché l'entalpia come proprietà termodinamica di un sistema è una funzione di stato, questo può essere calcolato da altre entalpie che si riferiscono a una sostanza in uno stato liquido con la stessa sostanza in uno stato gassoso.
Ad esempio, l'entalpia di vaporizzazione può essere calcolata sottraendo l'entalpia di sublimazione tranne l'entalpia di fusione di una sostanza. Quindi, questa entalpia e il numero di moli vengono utilizzati per determinare il calore di evaporazione del campione.
Può servirti: policloruro di alluminio: struttura, proprietà, ottenimento, usiApplicazioni di calore di evaporazione
Ci sono molti campi in cui viene utilizzato il calore di evaporazione. In effetti, in qualsiasi processo che coinvolge una sostanza chimica che una volta è in uno stato liquido e in un altro in uno stato gassoso, il calore dell'evaporazione interverrà.
Il calore di evaporazione è sempre positivo, poiché è sempre necessario assorbire il calore per rompere l'unione tra le molecole che formano un liquido. La sostanza assorbe questo calore dall'ambiente circostante, quindi perdono calore quando un liquido evapora.
Evaporazione Regolazione del calore e della temperatura corporea
Questo è il principio del funzionamento della sudorazione come sistema di regolazione della temperatura corporea.
Quando sudiamo, l'acqua di sudore evapora sulla superficie della nostra pelle. Poiché la pelle è in contatto diretto con il sudore, è qui che l'acqua ottiene il calore di evaporazione.
Quindi, durante l'evaporazione, l'acqua del sudore porta con sé una quantità di calore della pelle, che si raffredda, raffreddando anche il sangue che scorre attraverso i capillari della pelle e, in definitiva, l'interno del corpo.
Evaporazione del calore nell'industria
L'energia è uno dei maggiori costi per molti settori e molti di loro devono spendere energia per evaporare diverse sostanze. Per questo motivo, è necessario essere in grado di calcolare la quantità di calore richiesto per evaporare diversi liquidi per calcolare i costi operativi.
Ad esempio, se un'azienda farmaceutica sintetizza un farmaco in una soluzione alcolica, probabilmente dovrà evaporare e asciugare il prodotto per eliminare tutto l'alcol. Il calore di evaporazione ci consente di determinare quanta energia sarà necessaria per eseguire questo.
Può servirti: acido periódic (Hio4): cosa è, struttura, proprietà, usiProduzione di ghiaccio su un treno
Prima dell'esistenza dell'elettricità, i treni hanno usato il calore di evaporazione per congelare l'acqua e quindi fare ghiaccio durante il viaggio. Il processo è simile alla sudorazione e funziona allo stesso modo.
Alla stazione, il treno aggancia una borsa in pelle che contiene acqua liquida. La borsa non è perfettamente ermetica, quindi l'esterno è inumidito. Durante il viaggio, l'aria evapora rapidamente l'acqua dalla superficie del sacchetto, assorbendo il calore di acqua liquida e raffreddandola, al punto di congelarla.
Esempi di calore di evaporazione
La tabella seguente contiene riscaldamenti latenti di vaporizzazione o evaporazione per alcuni prodotti chimici comuni.
| Sostanza | Calore latente della vaporizzazione (LVAP/KJ.G-1) | Entalpia di vaporizzazione (∆VAPH/KJ.mol-1) |
| Acqua (h2O) | 2.260 | 40.657 |
| Etanolo (ch3Cap2OH) | 0.837 | 38.56 |
| Idrogeno solforato (H2S) | 0.6422 | 21.90 |
Riferimenti
- Ehu.È (s. F.). Calore latente della vaporizzazione dell'acqua. Preso da sc.Ehu.È.
- Luz, g. (S. F.). Calore di vaporizzazione. Preso da materiali.Gelsonluz.com.
- Soler & Palau (2019). Calore latente: fusione e vaporizzazione. Tratto da Solerpalau.com.
- Spiegato (2021). Qual è il calore della vaporizzazione? Tratto da Spiegato.com.

