Peso equivalente
- 1053
- 69
- Enzo De Angelis
Qual è il peso equivalente?
Lui peso equivalente È il peso o la massa di un equivalente di sostanza. Cioè, è il peso o la massa di una sostanza che è chimicamente uguale a 1 mole di un'altra sostanza dello stesso tipo che viene utilizzato come modello di riferimento ed è considerato normale.
La sostanza normale presa come riferimento dipende dal tipo di reazione chimica coinvolta e dal ruolo che il composto svolge in quella reazione. I composti normali reagiscono sempre tra loro con la stechiometria 1: 1.
Ad esempio, se parliamo di una reazione acida/base, il peso equivalente di un acido sarebbe il peso di detto composto equivalente a 1 mole di un acido normale, che è uno che ha un singolo protone ionizzabile.
Prima che si sapesse che la materia era formata da atomi e molecole, una serie di leggi che determinavano la relazione di massa (o il peso) tra i reagenti e i prodotti di una reazione chimica era già stata stabilita.
Queste leggi costituivano le basi dei calcoli stechiometrici durante l'inizio della chimica come scienza.
Il concetto di peso equivalente è legato a questa fase iniziale dello sviluppo chimico. Successivamente, discuteremo di come viene calcolato, a cosa serve e ad alcuni esempi comuni del tuo calcolo.
Formula e unità di peso equivalenti
Il peso equivalente viene calcolato dal peso molecolare di una sostanza mediante la seguente formula:
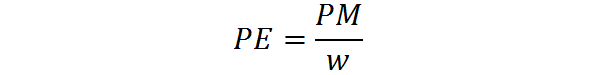
Dove PE è il peso equivalente, PM è il peso molecolare o la massa molare della sostanza e W rappresenta il numero di equivalenti per mol.
Quest'ultimo è sempre costituito da un numero intero ugualmente o maggiore. Rappresenta il numero di molecole di un reagente "normale" a cui ogni molecola di sostanza è equivalente. Pertanto, dipende dal tipo di reagente in questione e dal tipo di reazione chimica coinvolta.
Può servirti: diidrossicetone: struttura, proprietà, ottenimento, usiPuò anche essere calcolato dall'impasto, M e dal numero di equivalente:
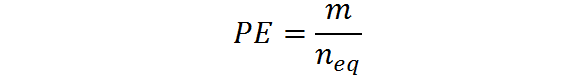
Unità di peso equivalenti
Come si può vedere dalla formula precedente, il peso equivalente è espresso in unità di massa (di solito grammi) sul numero di equivalenti. Cioè, le unità sono G/EQ.
Il valore di W Nella prima formula precedente è espresso in unità equivalenti su mol (EQ/mol), mentre la massa molare è espressa in grammi su mol (g/mol).
Qual è il peso equivalente?
L'utilità principale del peso equivalente è che semplifica i calcoli stechiometrici. Il peso equivalente di una sostanza è equivalente a un'altra sostanza dello stesso tipo e per lo stesso tipo di reazione chimica. In effetti, da lì ottiene il suo nome.
Questo ci consente di eseguire calcoli stechiometrici in un modo molto semplice e senza la necessità di scrivere ed bilanciare equazioni chimiche.
Come viene calcolato il peso equivalente?
Come abbiamo visto prima, il peso equivalente viene calcolato dal peso molecolare e il numero di equivalenti per mol o W.
Calcolo del peso molecolare
Il peso molecolare di una sostanza viene determinato aggiungendo il peso atomico di tutti gli atomi che lo compongono. Questi pesi atomici si trovano nella tavola periodica.
Determinazione di W
Il valore di W Per una sostanza dipende dal tipo di reazione in cui è coinvolto. Cioè, dipende dal tipo di reagente in questione. Per ogni tipo di sostanza esiste un modo diverso di determinare W.
La tabella seguente mostra come è determinata W Per diversi casi.
Può servirti: ipoclorito di calcio (CA (CLO) 2)| Tipo di reagente | Valore di W |
| Acidi | Numero di idrogeni ionizzabili per ogni molecola acida. |
| Basi | Numero di protoni che possono catturare o neutralizzare ogni molecola di base. |
| Agenti ossidanti | Numero di elettroni che catturano ogni mole di agente ossidante nella semi -stazione di riduzione. |
| Riducendo gli agenti | Numero di elettroni rilasciati ogni mole di riduzione dell'agente nella semi -distrazione dell'ossidazione. |
| Esci | Numero totale di cariche positive o negative che vengono generate quando uno dei sale. |
| Sostanze neutre | 1 |
Va notato che, se una sostanza può partecipare a più di un tipo di reazione chimica, potrebbe avere più di un valore di W E, quindi, più di un peso equivalente.
Importanza e applicazioni del peso equivalente
Il peso equivalente viene utilizzato per calcolare il numero di equivalenti di una sostanza chimica. Questo numero di equivalenti è sempre uguale al numero di equivalenti di un'altra sostanza con cui reagisce.
Questo è utilizzato principalmente in due aree diverse:
In chimica analitica
Gli equivalenti sono spesso usati per facilitare i calcoli stechiometrici nella chimica analitica. Ciò è particolarmente vero nel caso di analisi volumetrica e gravimetrica.
La conoscenza del volume del grado nel punto di equivalenza e la concentrazione del titolare, nonché il peso equivalente del diritto, consentire facilmente di calcolare la massa dell'analita presente in un campione.
In elettrolisi
Nel campo dell'elettrolisi, il peso equivalente rappresenta il peso di un metallo o altra sostanza che può verificarsi quando 96.500 C Caricamento attraverso la cella elettrolitica. Ciò facilita i calcoli stechiometrici ed economici del processo di elettrolisi.
Può servirti: ossido di mercurio (HG2O)Esempi del calcolo del peso equivalente
Calcio
Il peso atomico del calcio è 40 e questo metallo forma cationi con valencia +2, quindi il suo peso equivalente è 40/2 = 20 g/eq.
Acido solforico (h2SW4)
Il peso molecolare di questo composto è 98 ed è un acido diprotico, quindi W = 2. Pertanto, il peso equivalente è PE: 98/2 = 49 g/EQ.
Idrossido di alluminio (AL (OH)3)
L'idrossido di alluminio (PM = 78) è un composto anfoter che può agire come acido e come base.
Se agisci come base rilasciando i tuoi tre idrossidi, allora W = 3, Quindi PE: 78/3 = 26 g/eq. D'altra parte, quando funge da acido, cattura una molecola d'acqua e rilascia un protone, quindi, in questo caso, W = 1 e pe = 78 g/eq.
Fosfato di calcio (CA3(Po4)2)
Il fosfato di calcio è un sale che, quando si dissocia, produce 3 ioni CA2+ e 2 ioni po43-.
In ogni caso, il numero di carichi dello stesso segno che ogni unità di fosfato di calcio produce è 6, quindi W = 6 e pe = 310/6 = 51,67 g/eq.
Riferimenti
- Enciclopedia universale (s. F.). Peso equivalente. Tratto da enciclopedia_universal.ES-ACADEMIC.com.
- Chimica, chimica inorganica (s. F.). Peso equivalente. Preso da Fullquimica.com.
- Chimica.È (s. F.). Equivalente. Preso dalla chimica.È.
- Spiegato (2021). Qual è il peso equivalente? Tratto da Spiegato.com.

