Struttura di Berkelio (BK), proprietà, ottenimento, usi

- 4320
- 54
- Enzo De Angelis
Lui Berkelium È un elemento chimico il cui simbolo è BK. Appartiene alla classe di Actinids, essendo il suo ottavo membro. Il tuo numero atomico è 97. È un solido metallico sintetico. Questo elemento non si trova naturalmente sulla crosta terrestre. È presente in piccole quantità nei combustibili nucleari esauriti e ha una lucentezza d'argento.
Ci sono anche piccole quantità disperse nell'ambiente a causa dei test delle armi nucleari, a causa di gravi incidenti in impianti di energia atomica come Chernobyl e del rilascio che si verificano da rifiuti provenienti da impianti di energia nucleare.
 Simbolo, numero e massa atomica dell'elemento Berkelio. Fonte: ME/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/2.5). Fonte: Wikimedia Commons.
Simbolo, numero e massa atomica dell'elemento Berkelio. Fonte: ME/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/2.5). Fonte: Wikimedia Commons. Non è stata trovata un'utilità pratica per Berkelio, perché si verifica in quantità molto piccole e il fatto che tutti i suoi isotopi (atomi BK con diverso numero di neutroni nel nucleo) sono radioattivi. La sua applicazione principale è stata negli studi scientifici.
Sebbene i loro isotopi siano prodotti artificialmente in laboratori speciali e sono gestiti da personale esperto, i danni che le radiazioni pericolose emesse dovrebbero sempre essere prese in considerazione.
[TOC]
Nomenclatura
- Berkelio, simbolo BK.
- Berkelio-243, BK-243 o 243BK: Isotopo di Berkelio con massa atomica 243.
Scoperta
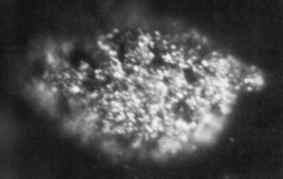 1.7 microgrammi di microfotografia di berkelio metallico solido ottenuto nel 1969. Oak Ridge National Laboratory, Dipartimento di Energia degli Stati Uniti / Dominio pubblico. Fonte: Wikimedia Commons.
1.7 microgrammi di microfotografia di berkelio metallico solido ottenuto nel 1969. Oak Ridge National Laboratory, Dipartimento di Energia degli Stati Uniti / Dominio pubblico. Fonte: Wikimedia Commons. Fu prodotto per la prima volta nel 1949 dagli scienziati Glen Seaborg, Stanley G. Thompson e Al Ghiorso alla Berkeley University in California, quando hanno bombardato l'Americio-241 con particelle alfa ad alta energia usando un ciclotrone (un acceleratore di particelle).
Immediatamente dopo l'irradiazione, il materiale è stato adeguatamente sciolto e passato attraverso una colonna di resina di scambio ionico, usando una soluzione di citrato di ammonio come eluente.
In questo modo hanno ottenuto un isotopo di elemento numero 97 con 243 massa atomica, che emette particelle alfa e ha una mezza vita di 4,5 ore.
Nome elemento
Inizialmente diversi ricercatori hanno proposto che l'elemento prendesse il nome di uno dei suoi scopritori, Glen Seaborg, dal momento che aveva il merito di essere riuscito a sintetizzare 10 elementi in diversi anni di lavoro.
Può servirti: becherTuttavia, l'Organizzazione ufficiale International Union of Pure and Applied Chemistry o Iupac (acronimo di inglese Unione Internazionale di chimica pura e applicata) decise di assegnare il nome "Berkelio" per essere stato ottenuto all'università e alla città di Berkeley (California).
 Apparizione di un'area dell'Università di Berkeley, Califronia. Autore: Sarangib. Fonte: Pixabay.
Apparizione di un'area dell'Università di Berkeley, Califronia. Autore: Sarangib. Fonte: Pixabay. Il nome Berkeley deriva dal filosofo Angloirlandés George Barkeley, un nome la cui pronuncia è poi cambiata negli Stati Uniti quando la città e l'università furono fondate nel 1869.
Questo è stato casualmente l'anno in cui Dmitri Mendeléyev ha pubblicato il suo primo tavolo periodico e ha iniziato a prevedere l'esistenza di nuovi elementi come Berkelio.
Struttura elettronica
La sua configurazione elettronica è:
1S2; 2S2 2P6; 3S2 3P6 3D10; 4S2 4P6 4D10 4F14; 5S2 5P6 5D10; 6S2 6P6; 5F9 7S2,
o compatto:
[RN] 5F9 7S2.
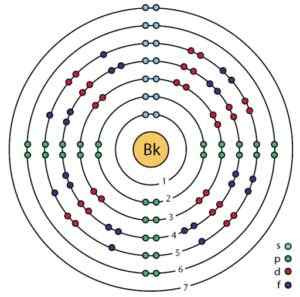 Struttura elettronica di Berkelio. Orbitali ed elettroni possono essere visti. Rasatura.Sciencewer/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons.
Struttura elettronica di Berkelio. Orbitali ed elettroni possono essere visti. Rasatura.Sciencewer/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons. Ottenimento
Il primo campione del metallo è stato preparato nel 1969 attraverso una reazione di riduzione del fluoro (BKF3) Con metallo al litio (Li) a una temperatura di 1300 K.
Per preparare fogli di metallo sottili, l'ossido BKO è ridotto2 Con Torio (Th) o Metallic Lantano.
Le proprietà fisiche di Berkelio
Stato fisico
Solido metallico appartenente.
Il metallo Berkelio ha due forme cristalline: alfa (esagono doppio compatto) e beta (centrata cubica su facce).
Massa atomica
247
Punto di fusione
1050 ºC (forma alfa)
986 ° C (forma beta)
Punto di ebollizione
2627 ºC
Densità
14,78 g/cm3 (forma alfa)
13,25 g/cm3 (forma beta)
Pararagnetismo
Secondo alcune fonti, alcuni composti di Berkelio mostrano proprietà paramagnetiche, il che significa che sono attratti da campi magnetici.
Questa caratteristica è di tipo paramagnetico perché quando si sostengono l'azione magnetica il materiale non riesce a mantenere tali proprietà da solo.
Proprietà chimiche
Ad alte temperature il berkelio metallico viene rapidamente ossidato in aria o ossigeno, formando i suoi ossidi. È facilmente solubile in acidi minerali, rilasciando idrogeno gas H2 e formare ioni BK3+.
Può servirti: idruro di alluminio (ALH3): struttura, proprietà, usiStati di ossidazione
Le indagini iniziali di questo elemento sono state limitate allo scambio ionico e agli esperimenti di coprecipitazione, con cui è stato osservato che lo stato di ossidazione +3 è stabile e il +4 è accessibile in soluzione acquosa, dal momento che il BK3+ Può essere ossidato dallo ione bromatico (fratello4-) Per dare bk4+.
Stabilizzazione BK4+
Nel 2017 è stata segnalata la stabilizzazione del BK4+ in soluzione usando il composto formato da gruppi di idrossipiridinone uniti a una struttura di poliammina (chiamata ligando 3,4,3-li (1,2-Hop)).
Questo composto ha otto luoghi in cui gli ioni si uniscono, che corrispondono agli atomi di ossigeno dei gruppi C = O e N-OH, lasciando il BK4+ saldamente collegato al ligando, rimanendo stabile.
Composti solidi
Il BK4+ può coprecipitare con cerio (CE4+) o zirconio (zr4+) in fosfato o yodato. Può anche essere estratto in soluzioni di esano di bis (2-etilhexil) idrogenoposfato o altro agente accomodante simile.
Il primo composto di Berkelio che si è verificato in quantità visibili era il cloruro (BKCL3), da cui sono stati ottenuti 0,000000003 grammi nel 1962. Da allora diversi composti di Berkelio sono stati in grado di prepararsi e studiare.
Possono essere menzionati ad esempio fosfato (BKPO4), ossicloruro (bkocl), fluoruri (BKF3 e bkf4), Biossido (BKO2), triossido (BK2O3), Yodatos (BK (IO3)3 e bk (io3)4), Cloroidrato [BKCL2(H2O)6] Cl, ossalato, composti organometali e composti di coordinazione, tra gli altri.
Nuovo stato di ossidazione +5
Nel 2018 un gruppo di investigatori di diversi paesi è riuscito a produrre un complesso di nitrati con pentavalent Berkelio (BK5+) la cui formula è BKO2(NO3)2-, eliminando due molecole2 dello ione BK (no3)4-, (BK3+).
I calcoli dell'energia computazionale hanno confermato che lo stato di ossidazione +5 è quello che ha la massima stabilità in questo complesso di nitrati berkenilo, quindi il più probabile.
Isotopi
Da Berkelio, 14 isotopi con masse atomiche sono stati sintetizzati da 238 a 251. Tutti sono radioattivi.
Può servirti: Benchilo: benzil idrogeni, carbocazioni, radicali benziliciIl più stabile è Berkelio-247, la cui emivita è di 1380 anni. Ogni atomo di questo isotopo quando disintegrante emette una particella alfa e forma un atomo di America-243.
Il BK-249 ha un'emivita di 330 giorni, soffre di decadimento beta e diventa California-249.
Applicazioni
Dal momento che sono stati in grado di ottenere solo piccole quantità di questo elemento, ha utilizzato solo nella ricerca scientifica di base.
Nel ottenere elementi più pesanti
L'isotopo BK-249 ha un'emivita relativamente lunga ed è possibile.
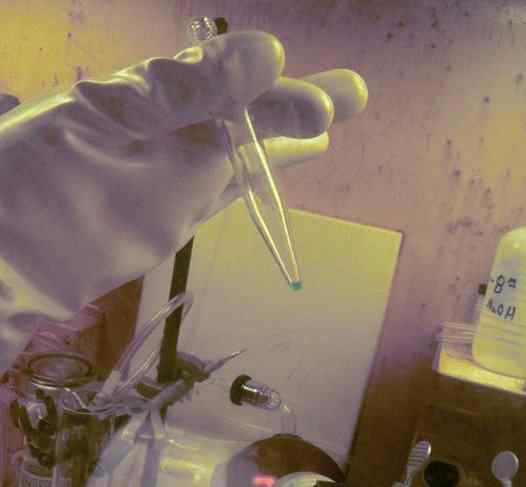 Microcanità BK disciolta in un tubo di prova. Sono stati usati 250 giorni per ottenerlo. Si può osservare il guanto di protezione della radioattività di questo elemento. ORNL, Dipartimento dell'Energia / Dominio pubblico. Fonte: Wikimedia Commons.
Microcanità BK disciolta in un tubo di prova. Sono stati usati 250 giorni per ottenerlo. Si può osservare il guanto di protezione della radioattività di questo elemento. ORNL, Dipartimento dell'Energia / Dominio pubblico. Fonte: Wikimedia Commons. Negli studi fisico -chimici
La ricerca condotta con il BK consente estrapolazioni più precise sulle proprietà e sul comportamento di altri elementi che seguono nella serie di recitazione, poiché gli elementi più pesanti sono più difficili da ottenere, hanno una vita in media molto breve e sono molto più radioattive.
Rischi
Berkelio è un elemento radioattivo. Il rilascio di radioattività nell'ambiente può raggiungere tutte le specie di animali e piante che causano danni ad essi. Il deterioramento può accumularsi nelle generazioni successive.
 Gli impianti di energia nucleare sono radioattivi e quindi molto pericolosi. Autore: AR130405. Fonte: Pixabay.
Gli impianti di energia nucleare sono radioattivi e quindi molto pericolosi. Autore: AR130405. Fonte: Pixabay. Riferimenti
- O.S. Biblioteca nazionale di medicina. (2019). Berkelium - BK (Element). Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Bianco, f.D. et al. (2019). Chimica contemporanea di Berkelium e California. Chimica 2019 6 agosto; 25 (44): 10251-10261. Recuperato da PubMed.NCBI.Nlm.NIH.Gov.
- Piombo, d.R. (Editor) (2003). Manuale CRC di chimica e fisica. 85th CRC Press.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Kelley, m.P. et al. (2018). Bond COVALECY e Stato di ossidazione dell'actinide INS complesso con agente chelante terapeutico 3,4,3-li (1,2-Hopo). Inorg. Chimica. 7 maggio 2018; 57 (9): 5352-5363. Recuperato da PubMed.NCBI.Nlm.NIH.Gov.
- Kovács, a. et al. (2018). Curum pentavalente, berkelium e californium nel complesso di nitrati: estensione della chimica dell'actinide e stati di ossidazione. Chimica. 6 agosto 2018; 57 (15): 9453-9467. Recuperato da PubMed.NCBI.Nlm.NIH.Gov.
- Orlova, a.Yo. (2007). Chimica e chimica strutturale di ortofosfi di actinide tri-totravalente anidro. Nella chimica strutturale dei composti di actinide inorganica. Recuperato da ScienceDirect.com.
- Chopppin, g. et al. (2013). Gli elementi di actinide e transattinide. In radiochimica e chimica nucleare (quarta edizione). Recuperato da ScienceDirect.com.
- Peterson, J.R. e Hobart, D.E. (1984). La chimica del berkelium. Progressi inorganici chimica, volume 28, 1984, pagine 29-72. Recuperato da ScienceDirect.com.
- Royal Society of Chemistry. (2020). Berkelium. RSC recuperato.org.
- « Storia della musica dalla preistoria
- Caratteristiche di pianificazione didattica, elementi, tipi, esempio »

