Affinità elettronica

- 2400
- 17
- Benedetta Rinaldi
Cos'è l'affinità elettronica?
IL Affinità elettronica È definita come la quantità di energia rilasciata quando un mole di atomi in stato gassoso è combinato con un mole di elettroni per formare una mole di anioni, anche in uno stato gassoso. In altre parole, si riferisce al negativo della variazione di entalpia del seguente processo:
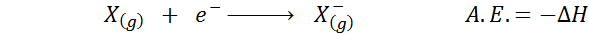
Come suggerisce il nome, l'affinità elettronica (a.E.) È una misura della tendenza che ha un atomo per unirsi a un elettrone. Cioè, misura l'affinità di un atomo per gli elettroni.
Interpretazione dell'affinità elettronica
A causa del modo in cui è definito, un'alta affinità elettronica implica che la variazione di entalpia è molto negativa. Questo, a sua volta, indica che il processo è energicamente favorevole e che i prodotti sono più stabili dei reagenti. Per questo motivo, potremmo anche dire che l'affinità elettronica è una misura indiretta della stabilità di un anione.
Maggiore è l'affinità elettronica di un atomo, maggiore è la tendenza a formare l'anione. Questo è il motivo per cui atomi come il cloro, la cui affinità elettronica è 349 kJ/mol, tendono a formare facilmente gli anioni (in questo caso l'anione del cloruro), mentre altri atomi come il magnesio, la cui affinità elettronica è negativa, non formano anioni.
Chiarimento sull'energia elettronica di affinità e ionizzazione
Molte volte pensi all'affinità elettronica come l'opposto dell'energia di ionizzazione (la tendenza di un atomo gassoso a perdere un elettrone), ma non è così. Considera, ad esempio, un atomo x.
Può servirti: Tusfrano: struttura chimica, proprietà e usiLa sua affinità elettronica si riferisce al cambiamento di energia del processo mostrato sopra nella prima equazione. Tuttavia, la sua energia di ionizzazione si riferisce al cambio di energia quando l'atomo perde un elettrone:
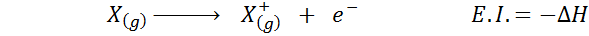
Sebbene questa reazione sembri essere la reazione opposta al precedente.
Ciò che determina l'affinità elettronica?
Per sapere quali caratteristiche di un atomo influenzano il valore della sua affinità elettronica, deve essere considerata la stabilità dell'atomo originale, così come quella dell'anione che si forma. Se l'anione è più stabile dell'atomo, l'affinità elettronica sarà alta, altrimenti sarà bassa o addirittura negativa.
Ma come sapere quale delle due specie è più stabile? Per questo, facciamo affidamento su due fattori:
- Configurazione elettronica. Esistono impostazioni elettroniche più stabili di altre. In generale, la configurazione a livello completo (come i gas nobili) è la più stabile di tutti. Quindi è seguito dalla configurazione del livello semi-lele, in cui tutti gli orbitali dello strato di Valencia hanno la metà degli elettroni che potrebbero avere (ad esempio, 4s14p3).
- Repulsione elettronica. Se viene confrontato un anione di carico -1, con un anione di carico -2, nel secondo caso ci sarà molta più repulsione tra gli elettroni, che destabilizza l'anione.
Tendenza di affinità elettronica periodica
 Grafico che mostra le affinità elettroniche dei primi 9 elementi della tabella periodica
Grafico che mostra le affinità elettroniche dei primi 9 elementi della tabella periodica L'affinità elettronica è una delle proprietà periodiche degli elementi. Cioè, è una proprietà che varia prevedibilmente da un elemento all'altro a seconda della sua posizione nella tabella periodica. In termini generali, l'affinità elettronica aumenta quando la dimensione dell'atomo diminuisce.
Può servirti: formula semi -sviluppata: cosa è ed esempi (metano, propano, butano ...)In questo senso, la dimensione degli atomi varia a seconda del periodo e del gruppo in cui si trova, quindi la sua affinità elettronica varia anche come spiegato di seguito:
Variazione dell'affinità elettronica per un periodo
Almeno per gli elementi rappresentativi (quelli appartenenti ai blocchi S e P della tabella periodica), si può osservare che l'affinità elettronica ha una tendenza generale ad aumentare da sinistra a destra, a causa dell'aumento dell'effettivo carico nucleare che è in grado di attrarre elettroni con una forza maggiore.
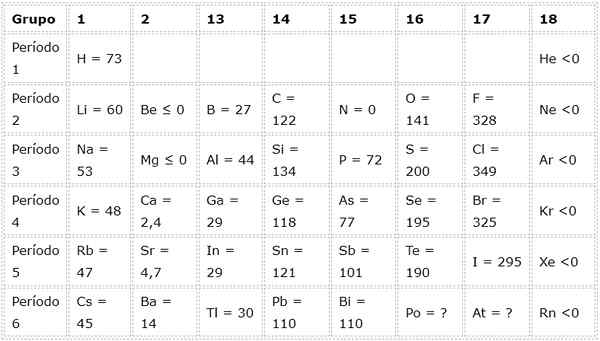
Ad esempio, se prendiamo il terzo periodo della tavola periodica, possiamo vedere che l'affinità elettronica di Li (60 kJ/mol) è inferiore a quella dell'ossigeno (141 kJ/mol) e questo è inferiore a quella del fluoruro (328 kJ /mol).
Eccezioni
La regola precedente non è sempre soddisfatta.
Innanzitutto, quando si sposta dai metalli alcalini agli alcalini, l'affinità elettronica diminuisce. Questo perché per i metalli alcalini (configurazione elettronica NS1) È favorevole catturare un elettrone, poiché finirebbero di riempire i loro orbitali.
Nel caso di alcalineros (configurazione elettronica NS2) catturare un elettrone è sfavorevole perché hanno già il loro pieno orbitale. Lo stesso accade quando si sposta da alogeni (che hanno le affinità elettroniche di tutti gli elementi) ai gas nobili.
Variazione dell'affinità elettronica in un gruppo
Nel caso dei gruppi, il comportamento è ancora meno prevedibile. La regola generale è che il a.E. aumenta dal basso verso l'alto, nella stessa direzione che riduce il raggio atomico. Per i metalli alcalini e alogeni, questa regola è soddisfatta abbastanza bene. Tuttavia, ciò non accade con la maggior parte degli altri gruppi.
Può servirti: idrossido di cobaltoEsempi di affinità elettronica di alcuni elementi rappresentativi
La tabella seguente mostra i valori di affinità elettronici in (kj/mol) di Gli elementi rappresentativi Ordinato per gruppo:
Di seguito sono riportati alcuni esempi di affinità elettronica insieme alla reazione a cui si riferiscono:
1. Affinità elettronica dell'idrogeno
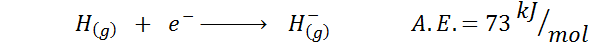
2. Affinità di ossigeno elettronico
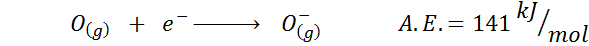
3. Affinità elettronica anionica
Un altro esempio comune è il caso dell'affinità elettronica di un anione come o-. Il a.E. In questo caso è data dall'energia associata al seguente processo:
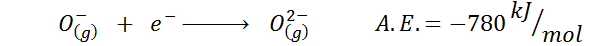
Come si può vedere, questa affinità elettronica è fortemente negativa, anche se lo ione o2- Ha la configurazione al neon elettronica (un gas nobile) e di essere uno ione molto comune in molti solidi ionici.
Il motivo è che la repulsione di cariche negative in o2- destabilizza questo ione statale gassoso, ma a stato solido il carico è stabilizzato dai cationi che lo circondano.

