Principio di Aufbau

- 4562
- 1172
- Rufo Longo
 Orbitali atomici che riempiono l'ordine secondo il principio di Aufbau
Orbitali atomici che riempiono l'ordine secondo il principio di Aufbau Qual è il principio di Aufbau?
Lui Principio di Aufbau, Conosciuta anche come regola di pioggia o principio di costruzione, è una regola pratica che consente di prevedere la configurazione elettronica della stragrande maggioranza degli elementi della tavola periodica, nonché quella delle sue ioni.
Questo principio stabilisce che, poiché i protoni vengono aggiunti al nucleo, uno per uno per costruire successivamente ogni elemento chimico, gli elettroni vengono anche aggiunti successivamente agli orbitali atomici meno energetici disponibili.
In altre parole, Aufbau ha stabilito che esiste un ordine specifico in base al quale possono essere riempiti gli orbitali atomici. Questo ordine è spiegato di seguito.
L'ordine di riempimento degli orbitali secondo il principio di Aufbau
L'ordine in cui vengono riempiti gli orbitali atomici dipende dal loro livello di energia. La regola d'oro è che questi livelli di energia sono riempiti dal meno al massimo, come se fosse un edificio in cui gli appartamenti dovessero essere riempiti ai piani più bassi per accedere ai pavimenti più alti.
In questo senso, per prevedere l'ordine di riempimento degli orbitali, dobbiamo prima sapere come sono ordinati in base al loro livello di energia. Nell'analogia dell'edificio, questo significa sapere quali appartamenti (orbitali) ci sono su ogni piano.
Il seguente grafico mostra i livelli di energia dei primi orbitali atomici ordinati dal più basso a maggiore energia.
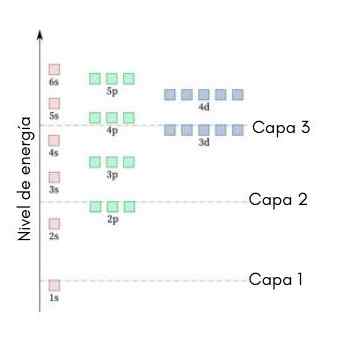
In questa immagine, ogni immagine rappresenta un particolare orbitale in cui si adattano solo 2 elettroni. Ogni gruppo di dipinti dello stesso colore rappresenta un sotto -livello di energia.
Questi sotto -livelli sono identificati da un numero e una lettera (1S, 3p, 3D, ecc.). Il numero indica il livello di energia principale, mentre la lettera indica il tipo di orbitale che forma il gruppo.
Può servirti: cloruro di alluminio (ALCL3)Secondo questo schema, il primo sotto -livello che deve essere riempito è il 1S (la minima energia di tutti), quindi arriva, il 2S, il 2p, il 3S, il 3p, il 4S, il 3D e così via.
La regola della pioggia
Nonostante quanto sia facile stabilire l'ordine di riempimento se si dispone di un grafico come il precedente, è difficile ricordare l'ordine particolare in cui vanno i diversi livelli secondari. Per questo, ciò che alcuni chiamano "la regola della pioggia".
Questa regola è composta da due semplici passaggi:
Passo 1
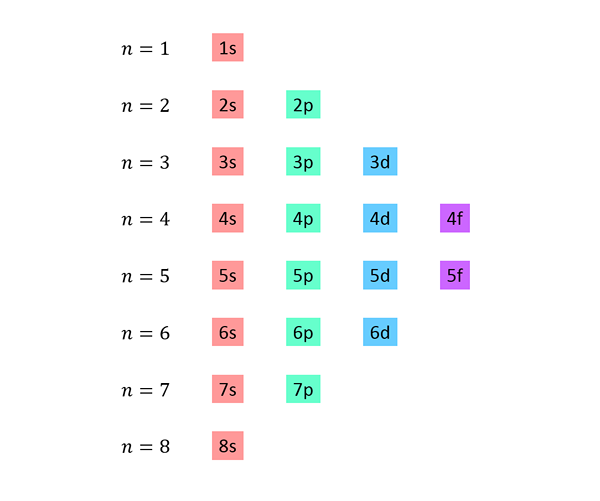
Viene effettuato un elenco in cui ogni riga corrisponde a un livello di energia e contiene uno dopo l'altro, tutti i sotto -livelli disponibili a quel livello di energia.
Ad esempio, la prima riga corrisponde al livello 1 (n = 1) e contiene solo il livello secondario 1S; La seconda riga corrisponde al livello n = 2 e contiene 2S e 2P sotto -livelli; Il terzo contiene i sotto -livelli 3s, 3p e 3D e così via.
L'elenco completo sembra questo:
Passo 2
Le diagonali discendenti sono disegnate da destra a sinistra, una sotto l'altra, come mostrato sotto.
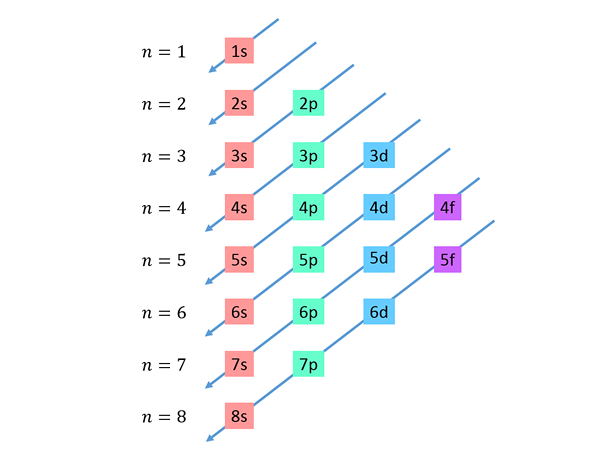
Queste linee assomigliano alla via dell'acqua gocce durante un vento con vento, quindi questo grafico viene solitamente chiamato "The Rain Method". L'ordine di riempimento è determinato dall'ordine in cui queste diagonali stanno toccando i livelli secondari nell'elenco.
Sulla base della figura precedente, l'ordine di energia degli orbitali e, quindi, l'ordine in cui devono essere riempiti è:
Può servirti: tavolo quantistico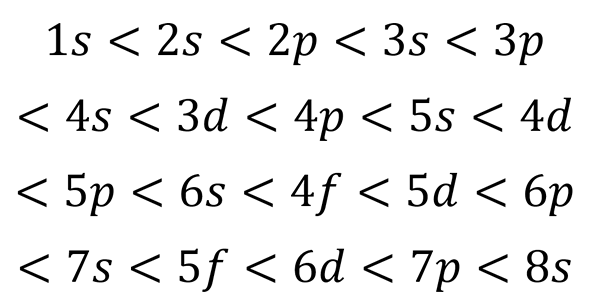
Questo ordine di riempimento è l'unico che conta davvero quando si scrive la configurazione elettronica di un atomo. Quando si riempie questi sotto -livelli, bisogna ricordare che nei livelli secondari S Solo 2 elettroni si adattano P adattarsi 6, nel D Si adattano a 10 e nel F Si adattano 14.
Eccezioni all'inizio di Aufbau
Il principio di Aufbau stabilisce chiaramente che un sotto -livello non può essere riempito fino a quando tutti i sotto -livelli precedenti non si sono completamente riempiti. Tuttavia, ci sono alcune eccezioni a questa regola.
In alcuni casi, l'atomo preferisce avere un sotto -livello di energia riempita proprio a metà che avere una incompleta che non è piena a metà. In questi casi, la configurazione elettronica effettiva dell'atomo non corrisponde all'ordine previsto con il metodo della pioggia.
Ad esempio, secondo il principio di Aufbau, l'atomo Chrome dovrebbe avere una configurazione elettronica che termina in 4s2 3d4. Tuttavia, la sua vera configurazione è 4s1 3d5 poiché così i sotto -livelli 4S e 3D vengono riempiti a metà mentre nell'altra configurazione no.
Lo stesso vale per il rame la cui configurazione termina in 4s1 3d10, invece di 4s2 3d9, Poiché così riempie D e S è pieno a metà.
Esempi dell'applicazione del principio di Aufbau
Successivamente, ci sono 5 esempi di elementi che soddisfano il principio di Aufbau:
Esempio 1: configurazione elettronica di sodio
Il sodio è l'elemento 11, quindi ha 11 protoni e 11 elettroni. La sua configurazione elettronica è 1s2 2s2 2 p6 3s1.
Esempio 2: Configurazione elettronica Argon
Argon (AR) è l'elemento 18, quindi ha 18 protoni e 18 elettroni. La sua configurazione elettronica è, quindi, 1s2 2s2 2 p6 3s23p6. Si può vedere che i suoi sotto -livelli e i livelli secondari erano completamente.
Può servirti: propilene (C3H6)Esempio 3: configurazione elettronica di gallio
Il gallio (GA) è l'elemento 31, quindi ha 31 protoni e 31 elettroni. La sua configurazione elettronica è 1s2 2s2 2 p6 3s23p64s23d104p1.
Questo può essere scritto in modo sommario come [ar] 4s23d104p1, dove [AR] rappresenta la configurazione elettronica dell'argon presentata nell'esempio precedente.
Esempio 4: configurazione elettronica in carbonio
Il carbonio (c) è l'elemento 6, quindi ha 6 protoni e 6 elettroni. La sua configurazione elettronica è 1s2 2s2 2 p2.
Esempio 5: configurazione di cloro elettronico
Il cloro (CL) è l'elemento 17. I suoi 17 elettroni sono distribuiti in base alla seguente configurazione elettronica: 1s2 2s2 2 p6 3s23p5 o [ne] 3s23p5.
Ulteriori esempi di eccezioni all'inizio di Aufbau
Successivamente, ci sono 2 ulteriori esempi di elementi che violano il principio di Aufbau:
Esempio 6: Configurazione elettronica di molibdeno
Il molibdeno (MO) è l'elemento 42. I primi 36 elettroni sono distribuiti allo stesso modo di Crypton, ma i suoi elettroni di valenza non seguono l'ordine normale. Invece di avere una configurazione elettronica [KR] 5S24d4, La sua configurazione è [Kr] 5s14d5, Simile a ciò che accade con Chrome.
Esempio 7: Configurazione elettronica d'argento
La Plata (AG, Element 47) presenta una violazione del principio di Aufbau simile a quello del rame. La sua configurazione elettronica è [KR] 5S14d10 Invece di [kr] 5s24d9.

