Struttura, funzioni e inibitori dell'acetilcolinesterasi
- 3530
- 571
- Silvano Montanari
IL acetilcolinesterasi (Acetilcolina acetilsa idrolese, EC 3.1.1.7) È un enzima che si trova principalmente nel sistema nervoso centrale. Il suo compito, come suggerisce il nome, è l'elaborazione idrolitica del neurotrasmettitore di acetilcolina.
È un enzima associato alla membrana cellulare che funziona insieme al ricevitore di acetilcolina per mediare l'eccitazione delle cellule postsinaptiche e il cui meccanismo catalitico è sorprendentemente veloce.
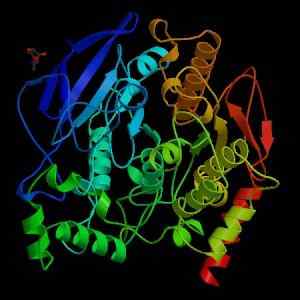
 Struttura dell'acetilcolinesterasi (Fonte: Wikimedia Commons)
Struttura dell'acetilcolinesterasi (Fonte: Wikimedia Commons) Dal punto di vista meccanico, questo enzima può essere visto come una serina-idrolasi e nel dominio catalitico del suo sito attivo contiene la triade di aminoacidi caratteristici delle proteasi: serina, istidina e residuo di acido. Tuttavia, il residuo acido è un glutammato, mentre le proteasi normalmente hanno un aspartato.
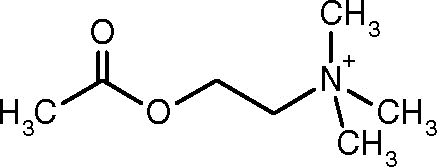 Struttura dell'acetilcolina (Fonte: AlineBloom [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons)
Struttura dell'acetilcolina (Fonte: AlineBloom [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons) Una delle prime osservazioni che collegava l'attività catalitica dell'acetilcolinesterasi con tessuti nervosi colinergici e tessuti muscolari fu quella fatta da Dale nel 1914; Successivamente è stato determinato che è presente anche nei neuroni non-raccolti e nelle cellule ematopoietiche, osteogeniche e neoplastiche.
Grazie allo studio di vari organismi, è attualmente noto che l'enzima è presente nella membrana di diversi tipi di cellule come eritrociti, nervi e cellule muscolari, organi elettrici e altri.
[TOC]
Struttura
Struttura terziaria e quaternaria
In condizioni naturali o "in vivo ", L'acetilcolinesterasi è un enzima polimorfico costituito da diverse subunità catalitiche di più o meno 80 kDa, che sono assemblate per formare una struttura oligomerica (di diverse subunità).
La quantità e la complessità di queste subunità dipendono dal tipo di cellula e dalle specie che sono considerate.
Alcune delle forme enzimatiche più complesse hanno subunità catalitiche con forme globulari (G) o asimmetriche (a) collegate da ponti disolfuro. I ponti disolfuro sono legami covalenti formati tra due molecole di zolfo dei gruppi TIOL (-sh) di due residui dell'acido in codice cisteina.
Ogni subunidad G contiene un singolo sito attivo, mentre le subunità A sono generalmente caratterizzate da tre domini strutturali, vale a dire: subunità catalitiche, code di collagene ricche di glicina, idrossiprolina e rifiuti di idrossilisina e altre code non collegeniche (diverse dal collagene).
Le forme asimmetriche di acetilcolinesterasi sono conosciute come A12, A8 e A4, che hanno rispettivamente subunità catalitiche 12, 8 e 4.
Può servirti: flora e fauna dall'Africa: specie rappresentativeGeneralmente, i residui del dominio catalitico nel sito attivo si trovano in una regione "profonda" delle subunità, che potrebbe essere vista come contraddittoria rispetto alla rapida velocità della reazione che catalizza questo enzima e l'apparente inaccessibilità del substrato a questi siti.
Indipendentemente dal polimorfismo enzimatico, le subunità sia globulari che asimmetriche hanno attività catalitiche simili.
Varianti
Alcune cellule diverse dalle cellule nervose, poiché gli eritrociti producono enzimi acetilcolinici prevalentemente globulari, dimetrici e per lo più associati con la faccia esterna della membrana plasmatica.
L'enzima degli eritrociti, sebbene di minore complessità strutturale, è anche un enzima anfipatico, il cui dominio catalitico attivo si trova nella grande regione idrofila, mentre il dominio idrofobico, che contiene la regione del carbossilico terminale, è responsabile del sostenerlo sulla membrane.
Struttura primaria
Gran parte delle attuali conoscenze sulla sequenza di acetilcolinesterasi sono nate dallo studio dell'enzima di Siluro californica, Un pesce di linea che vive nell'Oceano Pacifico e che è stato tradizionalmente usato come organismo modello per lo studio di diverse proteine del sistema nervoso.
Le subunità di acetilcolinesterasi sono sintetizzate come pro-proteine che vengono quindi elaborate per dare origine a subunità maturi. Ogni subunità è costituita da un polipeptide di circa 575 aminoacidi e 65 kDa di peso molecolare, che aumenta con l'aggiunta di rifiuti di carboidrati al 7-8% (glicosilazione).
L'attività catalitica del sito attivo delle subunità è determinata da un residuo di serina nella posizione 200, che si trova in una regione "profonda" delle subunità catalitiche.
Esistono diverse varianti o isoforme dell'enzima negli organismi grazie a luoghi diversi per i "giunzione alternativa " Dei messaggeri pre-arn su entrambe le loro estremità (5 'e 3'). La sequenza carbossil-terminale dell'isoforma di ciascuna subunità è quella che determina l'assemblaggio degli oligomeri tra loro.
Funzioni
L'acetilcolinesterasi è un enzima con molteplici funzioni biologiche non necessariamente correlate tra loro. Reso attestato dalla sua espressione differenziale durante l'embriogenesi, l'estensione neurale embrionale, lo sviluppo muscolare e la sinptogenesi.
Come precedentemente sottolineato, ha una funzione importante nella rapida idrolisi dell'acetilcolina e quindi nella regolazione del suo effetto sullo spazio sinaptico neuromuscolare o negli spazi sinaptici collori del sistema nervoso centrale del sistema nervoso centrale.
Può servirti: applicazioni di biologia nel bestiameUn esempio delle sue funzioni è la contrazione del muscolo scheletrico, che si verifica grazie a un tipo di sinapsi chimica nota come placca motoria, situata tra un motoneurone e una fibra muscolare.
In questa sinapsi si ottengono centinaia di vescicole caricate con acetilcolina, che vengono rilasciate dal motoneurone per la diffusione di un impulso elettrico.
Questo processo di neurotrasmissione è piuttosto complesso, tuttavia, la partecipazione dell'acetilcolinesterasi è cruciale per la terminazione della trasmissione sinaptica che dipende dal neurotrasmettitore di acetilcolina, poiché deve essere degradata e quindi diffondere al di fuori della synaptica per completare la fessura della membrana.
Pertanto, l'enzima acetilcolinesterasi è responsabile della regolazione della concentrazione di questo trasmettitore nella sinapsi neuromotora.
Altre funzioni "non classiche" dell'enzima sono correlate alla neuritogenesi o alla crescita delle cellule nervose; Con i processi di adesione cellulare, la sinaptogenesi, l'attivazione dei neuroni-dopamina nella sostanza nera del mesencefalo, i processi ematopoietici e il trombo poetico, tra gli altri.
Inibitori
Gli inibitori dell'acetilcolinesterasi lavorano idrolizzati in acetilcolina, aumentando così il livello e la durata dell'azione di questo neurotrasmettitore. Possono essere classificati, secondo il loro meccanismo d'azione, come reversibile e irreversibile.
Inibitori irreversibili
Sono quelli che inibiscono irreversibilmente l'attività idrolitica dell'acetilcolinesterasi a causa della loro giunzione covalente al residuo di serina nel sito attivo dell'enzima. Questo gruppo è composto principalmente da organofosfato.
In generale, questi sono composti attivi presenti in molti insetticidi e sono responsabili di un gran numero di decessi accidentali a causa dell'avvelenamento. Sono esteri o tioli derivati da acido fosforico, fosfonico, fosfina o fosforamídico.
Sarin, Tabun, Soman e ciclosarina sono tra i composti più tossici sintetizzati dall'uomo poiché possono uccidere un essere umano inducendo fallimenti respiratori e circolatori dovuti al blocco dell'acetilcolinesterasi nel sistema nervoso periferico.
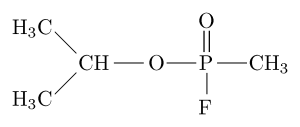 Struttura molecolare dell'inibitore organofosfato "Sarín" (fonte: Sivizius [dominio pubblico] via Wikimedia Commons)
Struttura molecolare dell'inibitore organofosfato "Sarín" (fonte: Sivizius [dominio pubblico] via Wikimedia Commons) Sarin, per esempio, è un "gas nervoso" che è stato usato come arma chimica per l'uso terroristico.
Inibitori reversibili
Questo ordine dei gruppi di classificazioni competitivi e non competitivi che lavorano attraverso la carbamilazione transitoria e reversibile di un residuo di serina sul sito attivo e molti sono stati sintetizzati e purificati da fonti vegetali o fungine.
Può servirti: SOKES: caratteristiche, struttura, funzioniCarbamati come la fisostigmina e la neostigmina sono inibitori reversibili che vengono usati come farmaci per il trattamento di malattie come il glaucoma e la miastenia grave, rispettivamente.
Altri agenti terapeutici di questo gruppo sono usati anche per il trattamento della malattia di Alzheimer, Parkinson's Parkinson, ostruzioni intestinali post-operatori (Ileo post-operatorio), distensione della vescica e come antidoti per l'overdosio.
Butirilcolinesterasi
Un interessante meccanismo naturale contro alcune sostanze inibitorie dell'acetilcolinesterasi ha a che fare con la partecipazione di un enzima meno specifico noto come butirilcolinesterasi.
Questo enzima è anche in grado di idrolizzare.
Acetilcolinesterasi e malattia di Alzheimer
È stato dimostrato che l'acetilcolinesterasi forma un complesso stabile con i componenti delle caratteristiche dei seni della patologia. Inoltre, alcuni modelli alterati di glicosilazione di questo enzima sono stati correlati alla presenza e alla formazione di placche amiloidi nel cervello.
Molti degli inibitori reversibili dell'acetilcolinesterasi, quindi, sono stati usati come farmaci di prima generazione per il trattamento di questa malattia e altre condizioni neurodegenerative correlate. Tra questi ci sono fatpezilo, rivastigmina e galantamina.
Riferimenti
- Dvir, h., Silman, i., Harel, m., Rosenberry, t. L., & Sussman, J. L. (2010). Acetilcolinesterasi: dalla struttura 3D alla funzione. Interazioni chimiche-biologiche, 187, 10-22.
- Houghton, p., Ren, e., & Howes, M. (2006). Inibitori dell'acetilcolinesterasi da piante e funghi. Rapporti sui prodotti naturali, 23, 181-199.
- Krsti, d. Z., Lazarevi, t. D., Bond, a. M., & Vasi, V. M. (2013). Inibitori dell'acetilcolinesterasi: farmacologia e tossicologia. Neuropharmacy attuale, undici, 315-335.
- Mukherjee, p. K., Kumar, v., Cattivo, m., & Houchton, P. J. (2007). Inibitori dell'acetilcolinesterasi dalle piante. Fitomedicina, 14, 289-300.
- Quinn, d. M. (1987). Acetilcolinesterasi: struttura enzimatica, dinamica di reazione e stati di transizione virtuale. Chimica. Rev., 87, 955-979.
- Raccchi, m., Mazzucchelli, m., Porrello, e., Lanni, c., & Govoni, s. (2004). Inibitori dell'acetilcolinesterasi: nuove attività di vecchie molecole. Ricerca farmacologica, cinquanta, 441-451.
- Rosenberry, t. (1975). Acetilcolinesterasi. Progressi nell'enzimologia e aree correlate della biologia molecolare, 43, 103-218.
- Soreq, h., & Seidman, s. (2001). Acetilcolinesterasi - Nuovi ruoli per un vecchio attore. Recensioni della natura, 2, 294-302.
- Tales, v. N. (2001). Acetilcolinesterasi nella malattia di Alzheimer. Meccanismi di invecchiamento e sviluppo, 122, 1961-1969.
- « Caratteristiche, struttura e funzioni ribulosa
- 14 tipi di contratto di lavoro e le loro caratteristiche »

