Struttura di ossido di stronzio (SRO), proprietà, applicazioni

- 4472
- 1235
- Benedetta Rinaldi
Spieghiamo ciò che l'ossido di stronzio, la sua struttura chimica, le proprietà fisiche e chimiche, le applicazioni e i rischi sono
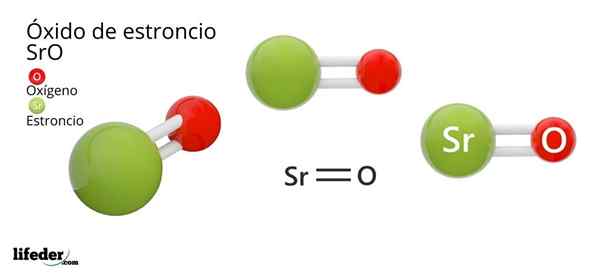
Lui Ossido di stronzio, la cui formula chimica è SRO (da non confondere con il perossido di stronzio, che è SRO2), è il prodotto della reazione ossidativa tra questo metallo e l'ossigeno presente nell'aria a temperatura ambiente: 2SR (S) + O2 (G) → 2SRO (S).
Un pezzo di stronzio brucia a contatto con l'aria a seguito della sua elevata reattività e in quanto ha una configurazione elettronica del tipo NS2, i suoi due elettroni di valenza sono facilmente producono, in particolare la molecola di ossigeno diatomico.
Se la superficie del metallo viene aumentata spruzzandolo fino a quando non ha una polvere finemente divisa, la reazione si verifica immediatamente e persino bruciando con un'intensa fiamma rossastra. Lo stronzio, il metallo che partecipa a questa reazione, è un metallo del gruppo 2 della tavola periodica.
Questo gruppo è costituito dagli elementi noti come alcalino. Il primo degli elementi guidati dal gruppo è il berillio, seguito da magnesio, calcio, stronzio, bario e, infine, la radio. Questi elementi sono di natura metallica e, come regola mnemonica per ricordarli, può essere usata l'espressione: “SR. Becambara ".
Il "MR" a cui si riferisce l'espressione non è altro che lo stronzio metallico (SR), un elemento chimico molto reattivo che non si trova naturalmente nella sua forma pura, ma combinato con altri elementi dell'ambiente o di ciò I suoi sali, nitruri e ossidi.
Per questo motivo, minerali e ossido di stronzio sono i composti in cui lo stronzio si trova in natura.
[TOC]
Proprietà fisiche e chimiche di ossido di stronzio
 Aspetto fisico di ossido di stronzio
Aspetto fisico di ossido di stronzio L'ossido di stronzio è un composto bianco, poroso e toilette solido e, a seconda del suo trattamento fisico, può essere trovato sul mercato come polvere fine, come cristalli o come nanoparticelle.
Può servirti: ossidiIl suo peso molecolare è di 103.619 g/mol e ha un indice di rifrazione elevato. Ha punti di fusione (2531 ºC) e ebollizione (3200 ° C), che si traducono in forti interazioni di collegamento tra stronzio e ossigeno. Questo elevato punto di fusione lo rende un materiale termicamente stabile.
Ossido di base
È un ossido altamente di base; Ciò significa che reagisce a temperatura ambiente con acqua per formare idrossido di stronzio (SR (OH) 2):
SRO (S) + H2O (L) → SR (OH) 2
Solubilità
Reagisce inoltre o mantiene l'umidità, caratteristica essenziale dei composti igroscopici. Pertanto, l'ossido di stronzio ha un'elevata reattività con l'acqua.
In altri solventi - ad esempio, alcoli come l'etanolo della farmacia o del metanolo - sono leggermente solubili; Mentre in solventi come acetone, etere o diclorometano, è insolubile.
Perché è così? Perché gli ossidi metallici -e ancora più quelli formati da metalli alcalinotherro -sono composti polari e quindi interagiscono in misura migliore con solventi polari.
Non solo può reagire con l'acqua, ma anche con l'anidride carbonica, producendo carbonato di stronzio:
SRO (S) + CO2 (G) → SRCO3 (S)
Reagisce con gli acidi - come ad esempio acido fosforico diluito - per produrre sale di sale e fosfato d'acqua:
3SRO (S) + 2 H3PO4 (Dil) → SR3 (PO4) 2 (S) + 3H2O (G)
Queste reazioni sono esotermiche, motivo per cui l'acqua prodotta è evaporata da alte temperature.
Struttura chimica
La struttura chimica di un composto spiega come sono i suoi atomi nello spazio. Nel caso di ossido di stronzio, presenta una struttura cristallina di tipo sale gemma, lo stesso sale da tavolo o cloruro di sodio (NaCl).
Può servirti: bicarbonato di calcioA differenza del NaCl, il sale monovalente -A è, con cationi e anioni di grandezza di carico (+1 per Na e -1 per il Cl) -, la SRO è bivalente, con carichi 2+ per SR e da -2 per O (O2-, anione di ossido).
In questa struttura ogni ione O2 (rosso) è circondato da altri sei ossidi voluminosi, che ospitano nei suoi interstizi ottaedrici risultanti gli ioni SR2+ (colore verde), più piccoli. Questo imballaggio o disposizione è noto come cellula unitaria cubica centrata su facce (CCC).
Tipo di collegamento
La formula chimica dell'ossido di stronzio è SRO, ma non spiega assolutamente la struttura chimica o il tipo di collegamento esistente.
Nella sezione precedente è stato menzionato che presenta una struttura di sale Gema; cioè una struttura cristallina molto comune per molti sali.
Pertanto, il tipo di collegamento è prevalentemente ionico, il che chiarirebbe perché questo ossido ha elevato punti di fusione e bollitura.
Poiché il collegamento è ionico, sono le interazioni elettrostatiche che tengono insieme gli atomi di stronzio e ossigeno: SR2+ O2-.
Se questo legame fosse covalente, il composto potrebbe essere rappresentato con collegamenti nella sua struttura di Lewis (omettendo gli elettroni di ossigeno non condivisi).
Applicazioni
Le proprietà fisiche di un composto sono essenziali per prevedere quali sarebbero le loro potenziali applicazioni nel settore; Pertanto, questi sono un riflesso macro delle sue proprietà chimiche.
Sostituto del piombo
L'ossido di stronzio, grazie alla sua elevata stabilità termica, trova molte applicazioni nelle industrie in ceramica, vetro e ottica.
Il suo utilizzo in questi settori è principalmente destinato a sostituire il piombo ed essere un additivo che conferisce colori e viscosità migliori alla materia prima dei prodotti.
Può servirti: affitto alogenuro: proprietà, ottenimento, esempiQuali prodotti? L'elenco non avrebbe fine, perché in nessuno di questi con vetro, smalti, ceramiche o cristalli in uno dei suoi pezzi, l'ossido di stronzio può essere utile.
Industria aerospaziale
Poiché è un solido molto poroso, può intersperare particelle più piccole e quindi fornire una serie di possibilità nella formulazione dei materiali, la luce da considerare dall'industria aerospaziale.
Catalizzatore
La stessa porosità consente di avere potenziali usi come catalizzatore (acceleratore di reazioni chimiche) e come scambiatore di calore.
Scopi elettronici
L'ossido di stronzio funge anche da fonte di produzione di StrBan puri per scopi elettronici, grazie alla capacità di questo metallo di assorbire raggi X; E per la preparazione industriale del suo idrossido, SR (OH) 2, e il suo perossido, SRO2.
Rischi per la salute
È un composto corrosivo, quindi può causare ustioni con un semplice contatto fisico ovunque nel corpo. È molto sensibile all'umidità e deve essere immagazzinato in spazi secchi e freddi.
Il prodotto sali della reazione di questo ossido con acidi diversi si comporta nel corpo e come sali di calcio e sono immagazzinati o espulsi da meccanismi simili.
All'epoca, l'ossido di stronzio da solo non rappresenta maggiori rischi per la salute.
Riferimenti
- Elementi americani. (1998-2018). Elementi americani. Recuperato dagli americani.com
- SHIVER & ATKINS. (2008). CHIMICA INORGANICA. Nelle strutture di solidi semplici (quarta ed., P. 84). Mc Graw Hill.
- Atsdr. Recuperato da ASDR: ATSDR.Centro per la prevenzione e il controllo delle malattie.Gov
- Clark, J. (2009). Chemguide. Recuperato da ChemGuide.co.UK
- Tiwary, r., Narayan, s., & Pandey, o. (2007). Preparazione dell'ossido di stonzio da Celestite: una recensione. Material Science, 201-211.

