Proprietà di ossido di cloro (v), struttura, usi

- 1433
- 0
- Kayla Serr
Lui Ossido di cloro (V) È un composto inorganico altamente instabile la cui formula chimica è Cl2O5. È uno dei tanti ossidi di cloro, che sono caratterizzati da specie molecolari o persino radicali.
Il cl2O5 Ha trovato solo la vita su carta e calcoli teorici; Tuttavia, la sua esistenza non è stata esclusa ed è probabile che alcuni possano essere caratterizzati (da tecniche di spettroscopia avanzata)). Ciò che a causa dei concetti generali di chimica può essere previsto per questo ossido, è che è l'anidride dell'acido clorico, HCLO3.
 Molecola Cl2O5. Fonte: Jynto [CC0].
Molecola Cl2O5. Fonte: Jynto [CC0]. L'ipotetica molecola di ossido di cloro (V) è mostrata sopra (V). Si noti che perché è una molecola, la presenza del CL+5; Ancora meno quando deve avere un tale potere polarizzante per forzare l'ossigeno, collegando in modo covalente.
Come ogni composto instabile, rilascia energia per decomporsi in prodotti più stabili; Processo che in molti casi è esplosivo. Quando il cl2O5 Rompe la libertà2 IO2. È teorizzato che nell'acqua, a seconda dell'isomero di CL2O5, Si possono formare diversi oxoacidi di cloro.
[TOC]
Proprietà
La massa molare del CL2O5 è 150.9030 g/mol. Da questa massa e la sua ipotetica molecola, si può ipotizzare che se potesse essere isolato sarebbe probabilmente un liquido oleoso; Naturalmente, confrontandolo con l'aspetto fisico del CL2O7.
Sebbene non possa essere isolato o caratterizzato, questo ossido di cloro è acido, covalente e deve anche avere un piccolo momento di dipolo. La sua acidità è comprensibile se viene analizzata l'equazione chimica della sua idrolisi:
Può servirti: legge di amagat: spiegazione, esempi, eserciziCl2O5 + H2O 2HCLO3
Essere l'HCLO3 L'acido clorico. La reazione inversa comporterebbe il caso in cui l'acido possa essere disidratato:
2HCLO3 => Cl2O5 + H2O
D'altra parte, quando il CL2O5 Non appena si verifica, si decompone:
2cl2O5 => 4clo2 + O2
È quindi una specie intermedia anziché un ossido che parla correttamente. La sua decomposizione deve essere così veloce (considerando che il CL è persino formato2O5), che non può essere rilevato dalle attuali tecniche di analisi strumentale.
Struttura dell'ossido di cloro (V)
Molecola
Nell'immagine superiore, è stata mostrata la struttura dell'ipotetica molecola Cl2O5 Con un modello di sfere e barre. Le sfere rosse rappresentano atomi di ossigeno e da verde a cloro. Ogni cloro ha un ambiente piramidale trigonale, quindi la sua ibridazione deve essere SP3.
Quindi, la molecola CL2O5 Può essere visto come due piramidi trigonali collegate da un ossigeno. Ma se si osserva con cura, una piramide guida i suoi atomi di ossigeno e l'altro fuori dal piano (nella direzione del lettore).
Da qui si presume che ci siano rotazioni nel collegamento o2Cl-o-cl2, rendere la molecola relativamente dinamica. Si noti che la formula o2Cloclo2 È un modo per rappresentare la struttura del CL2O5.
Struttura di Lewis
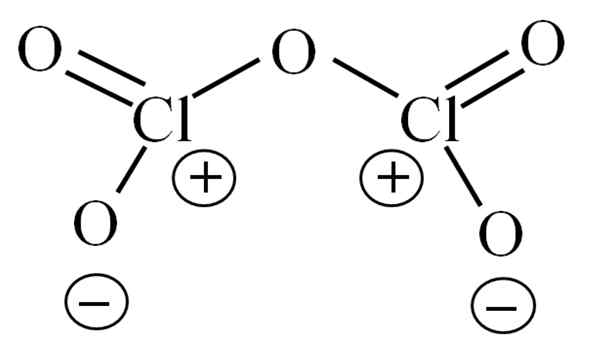 Struttura di Lewis per l'ipotetico Cl2O5. Fonte: Gabriel Bolívar.
Struttura di Lewis per l'ipotetico Cl2O5. Fonte: Gabriel Bolívar. Fino ad ora la molecola stessa non ha permesso di decifrare ciò che la sua instabilità è dovuta. Per far luce a questa domanda, viene utilizzata la sua struttura Lewis, rappresentata sopra. Si noti che si può pensare erroneamente che la struttura è piatta, ma nella sottosezione anteriore è stato chiarito che non è così.
Può servirti: sodio azido (NAN3): struttura, proprietà, usi, rischiPerché entrambi gli atomi di cloro hanno carichi formali positivi? Perché il cloro ha una coppia priva di elettroni, che può essere verificata quando viene applicata la teoria dei collegamenti di Valencia (che a causa della semplificazione non verrà eseguita qui). Pertanto, il suo carico formale è:
CF = 7 - (4 + 2) = 1
E cosa c'entra questo con la tua instabilità? Bene, il cloro è considerevolmente elettronegativo e quindi un cattivo portatore di carichi formali positivi. Questo ritorna al CL2O5 Una specie estremamente acida, poiché deve guadagnare elettroni per fornire la domanda elettronica dei due cloros.
Il contrario accade con il BR2O5 e l'i2O5, Ossidi che esistono in condizioni normali. Questo perché sia il bromo che lo iodio sono meno elettronegativi del cloro; E quindi supportano meglio il carico formale positivo.
Isomeri e la loro rispettiva idrolisi
Finora l'intera spiegazione è caduta su uno dei due isomeri del CL2O5: O2Cloclo2. Che è l'altro? Il o3Cloclo. In questo isomero i cloros mancano di carichi formali positivi e dovrebbero quindi essere una molecola più stabile. Tuttavia, sia o2Cloclo2 come il o3Cloclo dovrebbe subire reazioni di idrolisi:
O2Cl-o-cl2 + H2O => 2nd2Cl-oh (che non sono altro che l'HCLO3)
O3CL-O-CLO + H2O => o3CL-OH (HCLO4) + Ho-clo (HCLO2)
Si noti che si possono formare fino a tre ossoacidi di cloro: HCLO3, HCLO4 E hclo2
Nomenclatura
Il suo nome "ossido di cloro (v)" corrisponde al assegnato secondo la nomenclatura delle azioni. Il cl2O5 Può anche avere altri due nomi: pentaossido di dicloro e anidride clouring, assegnato da nomenclature sistematiche e tradizionali, rispettivamente.
Può servirti: titanio: storia, struttura, proprietà, reazioni, usiApplicazioni
Più che motivare gli studi informatici, il CL2O5 Non mancherà l'uso fino a quando non sarà scoperto, isolato, caratterizzato, memorizzato e ha dimostrato che non esplode al minimo contatto.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Sandra Luján Quiroga e Luis José Perissinotti. (2011). Oxoacidi di cloro e struttura degli ossidi di dicloro. Chimica. Educatore, vol. 16.
- Formulazione chimica. (2019). Ossido di cloro (V). Recuperato da: formulazione Quimica.com
- Linus Pauling. (1988). Chimica generale. Dover Publications, Inc., New York.
- Richard c. Ropp. (2013). Enciclopedia dei composti della Terra alcalina. Elsevier.

