Proprietà di ossido di cloro (iii), struttura, usi
- 5093
- 1639
- Silvano Montanari
Lui ossido di cloro (III) È un composto inorganico la cui formula chimica è CL2O3. Corrisponde all'anidride di cloro, HCLO2. È un solido marrone scuro, altamente esplosivo anche a temperature inferiori a 0 ° C e scarsamente caratterizzato. Ecco perché è soggetto all'interesse per gli studi informatici.
Chimicamente è un ossido covalente, quindi ci sono legami Cl-O e una molecola discreta di CL2O3 (Immagine inferiore). Questa molecola può ben formarsi con disidratazione dell'HCLO2, o sottoponendolo a basse temperature. Il dettaglio è che decompone producendo cl2, O2, o altri ossidi di cloro termodinamicamente più stabili.
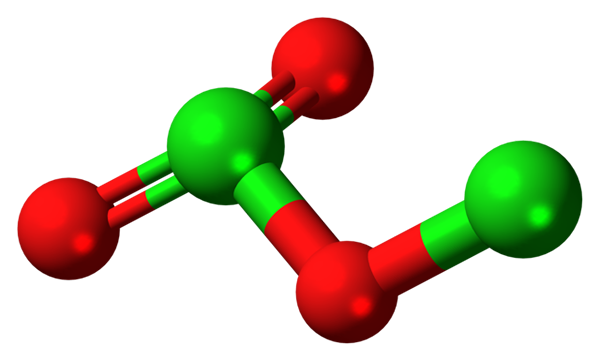
 Molecola di triossido di dicloro. Fonte: Jynto [CC0].
Molecola di triossido di dicloro. Fonte: Jynto [CC0]. Poiché i legami CL-O sono poco polari, l'e-mail CL2O3 Ha un piccolo momento di dipolo; Pertanto, non si dissolve bene in acqua o interagisce con altri solventi polari. La sua instabilità è tale che non è noto usi commerciali o potenziali (o come esplosivo la sua applicabilità sarebbe praticabile).
Il motivo principale della sua instabilità può essere dovuto alle caratteristiche elettroniche del presunto CL3+ (Supponendo un carattere puramente ionico). In effetti, i suoi stati di ossidazione +1 e +5 sono i più stabili quando il cloro si forma composti con ossigeno.
[TOC]
Proprietà
Poiché la sua caratterizzazione è scarsa e non documentata, non c'è molto da dire delle sue proprietà tranne i seguenti punti:
-Ha una massa molecolare di 118.903.
-È un solido marrone scuro; Anche se puoi sublimare il cloro gassoso, dicendo vapori verdi giallastri.
-Manca sia il punto di ebollizione che di fusione, poiché a 0ºC esplode (e anche a temperature più fredde).
Può servirti: diidrossicetone fosfato (DHAP): caratteristiche e applicazioni-La sua solubilità in acqua è stimata intorno a 3,42 g/100 ml, il che dimostra che è una molecola covalente di bassa polarità.
-Reagisce con l'acqua (il poco che si dissolve) per diventare l'HCLO2:
Cl2O3 + H2O 2HCLO2
Struttura dell'ossido di cloro (III)
Nell'immagine è stata mostrata la struttura molecolare del CL2O3 Con un modello di sfere e barre. Sebbene non sembri a causa dell'occhio nudo, le tacite implicazioni dei loro collegamenti e accordi spaziali sono più complicate di quanto sembrino. Questa struttura corrisponde a uno dei tanti possibili isomeri per questo composto.
Le sfere rosse corrispondono agli atomi di ossigeno e quelli verdi agli atomi di cloro. Il cloro a sinistra presenta geometria della piramide trigonale, con un paio di elettroni liberi; Quindi si può presumere che la tua ibridazione debba essere SP3. Un atomo di ossigeno funge da ponte tra i due cloros, cl-o-cl.
Isomeri
Quali sono gli altri isomeri? In teoria sono calcolati nove, di cui quattro sono i più stabili (inclusa l'immagine). Gli altri tre avrebbero strutture come:
-CLCLO3. Molto simile a quello spiegato, ma con un collegamento CL-CL.
-CloOocl (1). In questo isomero c'è un ponte di tre ossigeno che separa i due atomi di cloro (ricorda la geometria angolare di H2O per visualizzarlo).
-CloOocl (2). Lo stesso ponte ossigenato è presente anche in questo isomero, ad eccezione dei due atomi di cloro vengono eclissi nello spazio; uno davanti all'altro, mentre nel precedente isomero sono distanti.
Può servirti: AlquinosNomenclatura
Il suo nome, ossido di cloro (III), corrisponde al assegnato secondo la nomenclatura azionaria. Qui si presume che il cloro abbia uno stato di ossidazione di +3; Ma non significa che il cl cation3+ può essere presente. È una molecola, non una rete ionica.
Un altro nome con cui è noto anche il CL2O3 È triossido di dicloro, secondo la nomenclatura sistematica.
E finale. Questo nome è dovuto al fatto che, come già spiegato, il CL2O3 Si verifica quando l'HCLO2 Condensa ad annaffiare l'acqua.
Applicazioni
Perché è un ossido di cloro, l'uso più immediato che potrebbe essere pensato per il CL2O3 È come un agente ossidante, in grado di neutralizzare impurità e microbi organici. Tuttavia, è molto instabile, oltre all'esplosivo, in modo che a questo scopo sia considerato utile.
Sicuramente non ci sono informazioni nemmeno come si comporterebbe il CL2O3 sotto enormi pressioni (se non esplode nel processo). In condizioni normali, sembra non essere altro che un intermediario relativamente stabile e differenziale tra gli altri ossidi di cloro più stabili.
Computazionalmente, tuttavia, è stato soggetto allo studio per determinare i meccanismi da parte dei radicali liberi che coinvolgono diverse specie di cloro e ossigeno.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Dicloro di triossido. Recuperato da: in.Wikipedia.org
- Dagli l. Perry. (2011). Manuale di composti inorganici. (Seconda edizione). CRC Press Taylor & Francis Group.
- Richard c. Ropp. (2013). Enciclopedia dei composti della Terra alcalina. Elsevier.
- Kim K. H., Han e.K., e leggere e. S. (1999). Effetti impostati basati sulla stabilità degli isomeri Cl2O3 usando i metodi B3P86 e B3LYP di teoria funzionale della densità. Journal of Molecular Structure Theochem 460 (1-3): 19-25.
- « Struttura idrossido di ferro (ii), proprietà, usi
- Struttura della tetrodotossina, caratteristiche, usi, effetti »

