Caratteristiche, struttura, funzioni e test della troponina
- 3510
- 609
- Rufo Longo
Troponina È il nome che riceve una proteina presente nel muscolo scheletrico e cardiaco dei vertebrati, associata ai filamenti nelle fibre muscolari e che ha funzioni nella regolamentazione dell'attività contrattile (contrazione e rilassamento muscolare).
Le fibre muscolari sono le cellule che costituiscono il tessuto muscolare, la cui capacità di contrazione si basa sull'interazione tra i filamenti ordinati e strettamente associati all'interno, occupando la maggior parte del volume citoplasmatico.
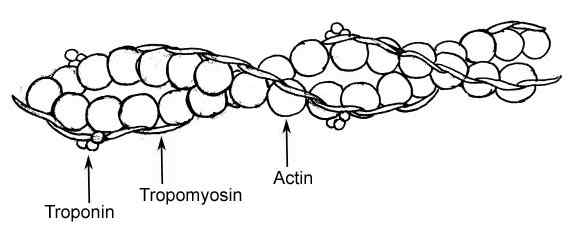 Rappresentazione grafica degli elementi di un filamento sottile nelle fibre muscolari (Fonte: Raul654, via Wikimedia Commons)
Rappresentazione grafica degli elementi di un filamento sottile nelle fibre muscolari (Fonte: Raul654, via Wikimedia Commons) Questi filamenti sono noti come miofilamenti e ci sono due classi: lo spessore e il sottile. I filamenti spessi sono composti da molecole di miosina II, mentre i filamenti sottili sono polimeri globulari di actina o actina G in associazione con altre due proteine.
Sia l'actina che la miosina si trovano anche in altre cellule del corpo umano e di altri organismi, solo in proporzione molto meno e partecipando a diversi processi come la migrazione cellulare, l'esocitosi, nella citocinesi (durante la divisione cellulare) e persino nel traffico vescicolare intracellulare.
La troponina e la tropomiosina sono le due proteine associate a sottili filamenti di actina che partecipano alla regolazione dei processi di contrazione e rilassamento delle miofibrille di cellule muscolari o fibre.
I meccanismi di azione attraverso i quali queste due proteine esercitano la loro funzione sono correlati alla concentrazione intracellulare di calcio. Il sistema di regolazione della troponina è uno dei sistemi più noti nella fisiologia e nella biochimica della contrazione muscolare scheletrica.
Queste proteine sono di grande importanza per il corpo. Al momento è noto per certo che alcune cardiomiopatie familiari o congenite sono il prodotto delle mutazioni nella sequenza dei geni che codificano per (troponina o tropomiosina).
[TOC]
Caratteristiche
La troponina è associata all'actina di sottili filamenti di fibre muscolari nei muscoli scheletrici e cardiaci in un rapporto stechiometrico da 1 a 7, cioè una molecola di troponina per ogni 7 molecole di actina.
Questa proteina, come stressato, si trova esclusivamente nei filamenti contenuti all'interno delle miofibrille delle fibre muscolari striate scheletriche e cardiache e non nelle fibre muscolari lisce che compongono i muscoli vascolari e viscerali.
È concepito da alcuni autori come la proteina regolatoria della tropomiosina. In questo modo, ha siti sindacali per l'interazione con le molecole di actina, il che gli dà la capacità di regolare la sua interazione con la miosina di filamenti spessi.
Può servirti: Aldohexosa: struttura molecolare ed esempiNei miofilamenti, la relazione tra molecole di troponina e tropomiosina è da 1 a 1, il che significa che per ogni complesso di troponina esiste c'è una molecola di tropomiosina associata a questo.
Struttura
La troponina è un complesso proteico composto da tre diverse subunità globulari conosciute come troponina I, troponina C e troponina T, che insieme si sommano, più o meno, 78 kDa.
Nel corpo umano ci sono varianti specifiche del tessuto per ciascuna di queste subunità, che differiscono l'una dall'altra a livello genetico e molecolare (per quanto riguarda i geni che le codificano), come a livello strutturale (per quanto riguarda il loro aminoacido sequenze).
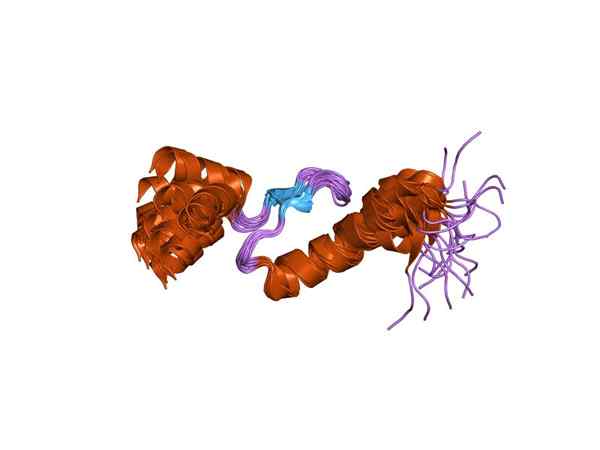
 Rappresentazione di una delle subunità della troponina (fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Domatura pubblica] tramite Wikimedia Commons)
Rappresentazione di una delle subunità della troponina (fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Domatura pubblica] tramite Wikimedia Commons) Toponin C o TNC è la più piccola delle tre subunità e forse una delle più importanti. Ha 18 kDa di peso molecolare e ha siti per unirsi al calcio (CA2+).
La troponina T o TNT è quella che ha i siti dell'Unione per ancorare il complesso delle tre subunità alla tropomiosina e ha un peso molecolare di 30 kDa; È anche noto come t -subunità o giunzione tropomiosina.
La troponina I o TNI, di poco più di 180 rifiuti di aminoacidi, ha lo stesso peso molecolare della troponina T, ma nella sua struttura ha i siti speciali per unirsi all'actina, bloccando l'interazione tra quest'ultimo e la miosina, che è il fenomenone responsabile per la contrazione delle fibre muscolari.
Molti libri di testo si riferiscono a questa subunità come la subunità inibitoria e come "pasta" molecolare tra le tre subunità della troponina. La sua capacità di unione di actina e la sua attività inibitoria è migliorata dalla sua associazione con la tropomiosina, mediata dalla subunità TNT.
È stato dimostrato che, nella subunità I, la regione della sequenza responsabile dell'inibizione è definita da un peptide centrale di 12 rifiuti di aminoacidi tra le posizioni 104 e 115; e che la regione C-terminale della subunità ha anche una funzione durante l'inibizione.
Funzioni
La funzione principale della troponina nella contrazione muscolare dipende dalla sua capacità di unire il calcio, poiché questa proteina è l'unico componente di filamenti sottili nel muscolo striato che questa proprietà ha.
In assenza di troponina, i filamenti sottili sono in grado di unire filamenti spessi e contratti, indipendentemente dalla concentrazione intracellulare di calcio, quindi la funzione della troponina è di evitare la contrazione in assenza di calcio attraverso la sua associazione con tropomiosina.
Può servirti: ovuliparosPertanto, la troponina svolge un ruolo importante nel mantenimento del rilassamento muscolare quando non c'è abbastanza calcio intracellulare e nella contrazione muscolare quando lo stimolo elettrico nervoso consente l'ingresso di calcio nella fibra muscolare.
Come accade questo?
Nei muscoli scheletrici e cardiaci striati, si verifica la contrazione muscolare grazie all'interazione tra filamenti sottili e spessi che scivolano l'uno sull'altro.
Nelle cellule di questi muscoli, il calcio è essenziale per l'interazione recitazione-morosina (filamenti sottili e spessi), poiché i siti dell'Unione dell'actina per la miosina sono "nascosti" dall'azione articolare della tropomiosina e della troponina, che è ciò che risponde al calcio.
Gli ioni di calcio che provengono dal reticolo sarcoplasmatico (il reticolo endoplasmatico delle fibre muscolari) si legano alla subunità C della troponina, che neutralizza l'inibizione mediata dalla troponina e la contrazione muscolare viene attivata.
La "neutralizzazione" dell'inibizione causata dalla subunità I si verifica dopo l'unione di calcio alla subunità C, che genera un cambiamento conformazionale che si diffonde tra le tre subunità e consente la sua dissociazione sia delle molecole di actina che della tropomiosina.
Questa dissociazione tra troponina, tropomiosina e actina espone nell'actina i siti dell'Unione per la miosina. È quindi che le teste globulari di quest'ultima possono interagire con le fibre di actina e iniziare la contrazione dipendente dall'ATP a causa dello spostamento di un filamento sull'altro.
Test della troponina
La troponina è il biomarcatore preferito per il rilevamento di lesioni cardiache. Pertanto, il test della troponina è ampiamente utilizzato nella diagnosi biochimica, precoce e/o preventiva, di alcune condizioni patologiche cardiache come l'infarto miocardico acuto.
Molti medici trattanti ritengono che questo test facilita la decisione rispetto a cosa fare e quale trattamento per somministrare i pazienti che hanno dolore toracico.
In generale, è correlato al rilevamento di subunità T e I della troponina, poiché la troponina C isforma si trova anche nei muscoli scheletrici della contrazione lenta; Cioè, non è specifico per il cuore.
Cos'è il test della troponina basato?
Il test della troponina è di solito uno studio immunitario che rileva le isoforme cardiache di T e I Subunità di troponina. Quindi, si basa sulle differenze che esistono tra le due isoforme.
Può servirti: sintesi proteicaIsoforma della subunità toponina I (CTNI) (CTNI)
Nel tessuto muscolare del miocardio c'è solo una isoforma della subunità I della troponina, caratterizzata dalla presenza di una "coda" post-traduzionale di 32 aminoacidi alla sua estremità N-terminale.
Questa isoforma viene rilevata grazie allo sviluppo di specifici anticorpi monoclonali che non riconoscono altre isoforme non cardiache, poiché la coda di aminoacidi è più o meno diversa dal 50% dalle estremità di altre isoforme.
Il CTNI non è espresso in tessuti danneggiati, ma è esclusivo per il tessuto cardiaco adulto.
Isoforma della subunità Troponina T (CTNT) (CTNT)
L'isoforma cardiaca della subunità t della troponina è codificata in tre diversi geni, il cui ARNM può subire tagli e giunzioni alternative che provocano la produzione di isoforme con sequenze variabili alle estremità N-e C-terminali.
Sebbene il muscolo cardiaco degli esseri umani contenga 4 isoforme TNT, solo una è una caratteristica del tessuto cardiaco di un adulto. Questo viene rilevato con anticorpi specifici progettati contro l'estremità N-terminale della sua sequenza aminooacida.
I test della "nuova generazione" per la subunidità t dell'isoforma cardiaca prestano molta attenzione al fatto che alcuni tessuti scheletrici feriti possono riespresare questa isoforma, quindi le reazioni incrociate possono essere ottenute con gli anticorpi.
Riferimenti
- Babuin, l., & Jaffe, a. S. (2005). Troponina: il biomarcatore preferito per il rilevamento di lesioni cardiache. Cmaj, 173(10), 1191-1202.
- Collinson, p., Stubbs, p., & Kessler, a.-C. (2003). Valutazione multicentrica del valore diagnostico della troponina cardiaca T, della massa CK-MB e della mioglobina per valutare i pazienti con sospetta sindromi coronariche acute nella pratica clinica di routine. Cuore, 89, 280-286.
- Farah, c., & Reinach, F. (1995). Il complesso di troponina e la regolazione della contrazione muscolare. Faseb, 9, 755-767.
- Keller, t., Peetz, d., Tzikas, s., Roth, a., Czyz, e., Bickel, c.,... Blankenberg, s. (2009). Troponina sensibile I test nella diagnosi precoce dell'infarcazione miocardica acuta. Il New England Journal of Medicine, 361(9), 868-877.
- Ross, m., & Pawlina, W. (2006). Istologia. Un testo e atlante con cellule correlate e biologia molecolare (5 ° ed.). Lippinott Williams & Wilkins.
- Wakabayashi, t. (2015). Meccanismo della regolazione del calcio della contrazione muscolare. Alla ricerca della sua base strutturale. Proc. Jpn. Acade. Essere. B, 91, 321-350.
- « Caratteristiche, struttura e funzioni della tropomiosina
- Concetto di calore sensibile, formule ed esercizi risolti »

