Atomo di carbonio
- 3113
- 728
- Benedetta Rinaldi
Spieghiamo qual è l'atomo di carbonio, la sua struttura elettronica, le caratteristiche e l'ibridazione orbitale.
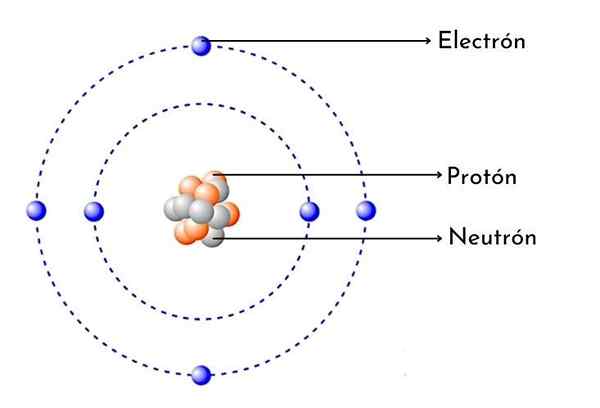
 Schema atomo di carbonio
Schema atomo di carbonio Cos'è l'atomo di carbonio?
Il carbonio è l'elemento numero 6 della tabella periodica ed è uno degli elementi più importanti esistenti. La sua importanza deriva da una chimica molto ricca e varia che fa formare questo elemento il Base della vita sul pianeta terra, come sappiamo.
Si tratta di un metalloide appartenente a Gruppo 14 della tabella periodica (precedentemente gruppo 4a) e il secondo periodo. Nella sua forma naturale, è associato al carbone (sia minerale che vegetale) e fuliggine, in cui è principalmente sotto forma di grafite o altro alotropo.
Lui Atomo di carbonio È tra i più piccoli della tavola periodica. È un atomo tetravalente, cioè può formarsi fino a quattro link con altri atomi uguali o diversi dallo stesso.
Il carbonio è di grande importanza per gli umani. È uno dei componenti principali del nostro corpo, che forma più del 19% della sua massa. Inoltre, ha anche più applicazioni tecnologiche derivate dalle sue proprietà atomiche.
Caratteristiche dell'atomo di carbonio
- L'atomo di carbonio è un non metal: Carbon è un elemento non metallico che può essere combinato con molti altri elementi della tabella periodica. Gli atomi di carbonio possono acquisire o dare elettroni ad altri atomi, diventando rispettivamente anioni o cationi.
- Ha 6 protoni nel suo nucleo: Il numero atomico di carbonio è 6, il che significa che ha 6 protoni nel suo nucleo. Significa anche che un atomo di carbonio neutro ha 6 elettroni attorno al nucleo.
Può servirti: separazione magnetica- Appartiene al blocco P della tavola periodica: La configurazione elettronica del carbonio nel suo stato fondamentale è 1s2 2s2 2 p2. Come si può vedere, gli ultimi elettroni di Valencia si trovano in orbitali P, quindi il carbonio appartiene al blocco P della tavola periodica.
- Le valenze dell'atomo di carbonio sono +2, +4 e -4: Lo strato di valenza del carbonio manca solo 4 elettroni per riempire completamente e quindi acquisire la configurazione elettronica del gas nobile neon. Per questo motivo, il carbonio può formare l'anione in carburo, c4-, che ha 4 elettroni in più del carbonio neutro. D'altra parte, l'atomo di carbonio può anche perdere i due elettroni 2p, diventando così il catione di carbonio (c2+) o tutti e 4 gli elettroni a Valencia, diventando il catione carbonico (C4+).
- Puoi formare più alotropi: Il carbonio elementare può essere trovato in due forme naturali comuni che sono grafite e diamante, che hanno proprietà radicalmente opposte. Inoltre, puoi formare diversi nanotubi di carbonio e grafene.
I tre isotopi dell'atomo di carbonio
Tutti gli atomi di carbonio hanno sei protoni nel loro nucleo, ma non tutti hanno lo stesso numero di neutroni, dando origine a tre isotopi:
- Carbon-12 (12C): È il più stabile e abbondante (circa il 98,9%). Ha 6 neutroni nel suo nucleo.
- Carbon-13 (13C): Ha 7 neutroni.
- Carbon-14 (14C): È l'uso radioattivo e usa per le date di vecchi oggetti.
Struttura elettronica dell'atomo di carbonio
Come ogni atomo di carbonio, ha sei protoni positivi nel suo nucleo, quindi ha anche 6 elettroni con carico negativo che gira.
Può servirti: aliquot (chimica)Il modo in cui questi elettroni sono distribuiti o la configurazione elettronica dell'atomo di carbonio è:
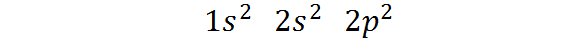
Questa configurazione elettronica indica che Il carbonio ha 2 elettroni nell'orbitale 1S, Due elettroni in Orbital 2s, E Due elettroni distribuiti tra i tre orbitali 2p.
D'altra parte, lo strato di valenza per il carbonio è lo strato L, che corrisponde al livello n = 2, poiché è lo strato di livello più alto contenente elettroni. Come possiamo vedere, il carbonio ha in totale 4 elettroni al livello 2, Quindi lo diciamo Ha 4 elettroni Valencia.
Questo è il motivo per cui il carbonio si trova in cui era precedentemente chiamato gruppo 4A della tavola periodica.
Ibridazione orbitale atomica nell'atomo di carbonio
Gli atomi reagiscono e si collegano tra loro attraverso i loro elettroni di valenza e gli orbitali che occupano. Tuttavia, questi ultimi non hanno sempre un orientamento adeguato per formare i collegamenti necessari.
La teoria dei collegamenti di Valencia afferma che gli atomi mescolano i loro orbitali atomici per formare nuovi orbitali ibridi che hanno una guida adeguata. Questo processo è chiamato ibridazione.
A seconda del numero di atomi a cui è collegato un atomo di carbonio, mescolerà o ibriderà un numero diverso di orbitali atomici puri. Questo dà origine a Tre diverse ibridazioni, Quali sono:
Sp
Si verifica quando il carbonio è collegato solo a Due atomi. In questo caso, l'orbitale S con uno dei tre orbitali P viene miscelato, dando origine a due orbitali SP che indicano in direzioni opposte (180º l'una dall'altra).
Può servirti: barometro al mercurioI due orbitali p che vengono lasciati senza miscelazione vengono utilizzati per formare legami PI. L'atomo di carbonio può formarsi Un triplo link (che contiene due legami PI) con un singolo atomo o può formare Due doppi collegamenti, uno con ogni atomo (e con un collegamento pi ciascuno).
Sp2
Quando Carbon vuole unirsi Tre atomi, Hai bisogno di tre orbitali ibridi, quindi mescola tre orbitali puri: le S orbitali e due orbitali p. Questo genera tre orbitali ibridi SP2 che punta agli angoli di un triangolo equilatero.
La P orbitale che non è stata utilizzata, può formare un collegamento PI con uno dei tre atomi collegati, dando origine a un doppio legame.
Sp3
Quando il carbonio si collegherà a Quattro atomi, Mescola i 4 orbitali puri dello strato di valenza per generare 4 SP orbitale ibrida3. Questi indicano i vertici di un normale tetraedro.
Poiché non ci sono orbitali per formare legami PI, un carbonio con ibridazione SP3 Puoi formare solo quattro semplici link e nessun link multiplo.
Riferimenti
- Britannica, i redattori dell'Enciclopedia. Carbon - fatti, usi e proprietà. Tratto da https: // www.Britannica.com/scienza/carbonio-chimico-elemento
- Laboratorio di monitoraggio globale. (S. F.). Gas serra del ciclo di carbonio. Tratto da https: // gml.Noaa.Gov/CCG/isotopi/chimica.Html

