Colorazione Giemsa
- 2173
- 40
- Lidia Valentini
 La colorazione di Giemsa è un metodo comune per esaminare vari tessuti e campioni di sangue
La colorazione di Giemsa è un metodo comune per esaminare vari tessuti e campioni di sangue Cos'è la colorazione di Giemsa?
IL Colorazione Giemsa È un tipo di campioni clinici (tessuti, sangue), basato sulla miscela di acido e coloranti di base. Ha creato Gustav Giemsa, chimico e batteriologo tedesco, che ha perfezionato il lavoro di Romanowsky aggiungendo glicerolo per stabilizzare i composti.
Le modifiche generate alla tecnica originale Romanowsky hanno permesso di migliorare significativamente le osservazioni microscopiche, quindi la tecnica è stata battezzata con il nome della colorazione Giemsa.
Essendo una tecnica semplice da eseguire, di grande funzionalità ed economica, è attualmente ampiamente utilizzato nel laboratorio clinico per l'odore ematologico, campioni di midollo osseo e tagli ai tessuti.
La tecnica di colorazione di Giemsa è molto utile per gli studi citologici, poiché consente l'osservazione di specifiche strutture cellulari. Questa tecnica colora citoplasie, nuclei, nucleolos, vacuoli e granuli cellulari, distinguendo persino le tracce di cromatina fine.
Inoltre, è possibile rilevare cambiamenti significativi delle dimensioni, della forma o della colorazione del nucleo, dove è possibile.
Fondazione della colorazione di Giemsa
I coloranti di tipo Romanowsky hanno come contrasto di base tra acido e coloranti di base, per uccidere le strutture di base e acide, rispettivamente. Come si può vedere, c'è un'affinità dei coloranti acidi di tintura delle strutture di base e viceversa.
Il colorante di base usato è il blu di metilene e i suoi derivati arrugginiti (Azure A e Azure B), mentre il colorante acido è eosina.
Le strutture acide delle cellule sono acidi nucleici, i granuli del basofilo segmentato, tra gli altri. Pertanto, saranno tinti di blu di metilene.
In questo stesso senso, le strutture di base delle cellule sono emoglobina e alcuni granuli, come il contenuto negli eosinofili segmentati, tra gli altri. Questi saranno tinti con Eosina.
D'altra parte, poiché il metilene e il blu di Azure sono caratterizzati da coloranti metacromatici, possono fornire un tono variabile alle diverse strutture, secondo il carico di poliianioni che possiedono.
Questo è il modo in cui la combinazione strategica di coloranti di base e acida riesce a sviluppare un ampio spettro di colori, secondo le caratteristiche biochimiche di ogni struttura, che camminano attraverso sfumature blu pallida, blu scuro, lilla e viola blu, nel caso di strutture acide acide.
La colorazione fornita da Eosina è più stabile, generando colori tra rossastro, arancione e salmone.
Materiali
Preparazione della soluzione madre
La preparazione della soluzione madre richiede una pesatura di 600 mg di polvere di Giemsa, misurando 500 cc di alcool meticolico senza acetone e 50 cc di glicerina neutra.
Modalità di preparazione
Posizionare la pesante polvere di Giessa su un mortaio. Se ci sono grumi, devono essere polverizzati. Successivamente, aggiungi una quantità apprezzabile della glicerina misurata e mescola molto bene. La miscela ottenuta viene versata in una bottiglia ambra molto pulita.
Il resto della glicerina è collocato nel mortaio. Mescola di nuovo per pulire il resto della tintura che è stato bloccato alle pareti del mortaio e lanciare la stessa bottiglia.
Può servirti: conidiaLa bottiglia è coperta e richiede 2 ore a bagno d'acqua a 55 ° C. Finché.
Successivamente, la miscela può raffreddare per posizionare l'alcol. In precedenza, una parte dell'alcool misurato viene inserita nel mortaio per finire il lavaggio di ciò che è colorante e quindi viene aggiunta alla miscela, accanto al resto dell'alcool.
Questa preparazione dovrebbe essere autorizzata a maturare per almeno 2 settimane. La parte utilizzata dalla soluzione madre deve essere filtrata.
Per evitare la contaminazione della preparazione, si consiglia di passare la porzione che verrà costantemente abituata a una piccola bottiglia ambrata con gocciolamento. Reracharge ogni volta che il reagente è esaurito.
Preparazione della soluzione tampone
D'altra parte, viene preparata una soluzione tampone PH a 7,2: come segue:
6,77 gr di sodio fosfato (anidro) (Nahpo sono pesati4), 2,59 gr di diidrogeno fosfato di potassio (KH2Po4) e acqua distillata fino a 1.000 cc.
Preparazione della colorazione finale
Per la preparazione della soluzione di colorazione finale, sono misurati e miscelati 2 cc della soluzione madre filtrata. La miscela è agitata.
Un fatto pertinente che deve essere preso in considerazione è che le tecniche di preparazione del colorante possono cambiare secondo la casa commerciale.
Materiali aggiuntivi necessari per eseguire la colorazione
Oltre ai materiali descritti, ai ponti di colorazione, a gradini con acqua o tampone per il lavaggio, fette di scorrimento o copertura, un cronometro, un cronometro per controllare i tempi di colorazione e la carta di asciugatura o del materiale che serve a asciugare (garza o cotone (garza o cotone).
Tecnica
Processo di colorazione
1. Prima della colorazione, il campione esteso su una diapositiva pulita dovrebbe essere pronto.
I campioni possono essere sangue, midollo osseo, tessuti istologici o campioni cervicali-vaginali. Si consiglia che quelli estesi vadano bene e abbiano 1 o 2 ore di asciugatura prima di colorarli.
2. Su un ponte di colorazione sono posizionati tutti i fogli che devono colorare. Funziona sempre nello stesso ordine e ogni foglio è identificato bene.
3. Posizionare alcune gocce di alcol di metallo al 100% (metanolo) sull'odore e parti per 3-5 minuti, al fine di riparare e disidratare il campione.
4. Scartare il metanolo presente nel foglio e lasciare asciugare in aria.
5. Una volta asciutto, posizionare la soluzione di colorazione finale con un contagocce fino a quando non copre l'intero foglio. Lascia l'atto per 15 minuti. Alcuni autori raccomandano fino a 25 minuti. Dipende dalla casa commerciale.
6. Scolare il colorante e lavare lo sfregamento con acqua distillata o con una soluzione tampone 7.2.
7. Su una carta di asciugatura, lascia asciugare i fogli all'aperto, disposti verticalmente con l'aiuto di un supporto.
Può servirti: Renina: struttura, produzione, secrezione, funzioni8. Pulire la parte posteriore del diapositiva con garza o cotone inumidita in alcol per eliminare qualsiasi resto del colorante.
Usi/applicazioni della colorazione di Giemsa
La tecnica di colorazione di Giemsa è utilizzata in varie aree: in ematologia, micologia, batteriologia, parassitologia, citologia e citogenetica.
Ematologia
È l'uso più frequente che viene dato a questa colorazione. Con esso, viene identificata ognuna delle cellule presenti nei campioni di midollo osseo o nel sangue periferico. Oltre a calcolare il numero di ciascuna serie, essere in grado di rilevare la leucocitosi o leucopenia, trombocitopenia, ecc.
Poiché è sensibile identificare le cellule immature, è rilevante nella diagnosi di leucemia acuta o cronica. È anche possibile fare la diagnosi di anemie, come l'anemia drepanocitica, falciforme, tra gli altri.
Micologia
In quest'area il suo utilizzo è comune per la ricerca Histoplasma capsulatum (fungo dimorfico intracellulare) in campioni di tessuto.
Batteriologia
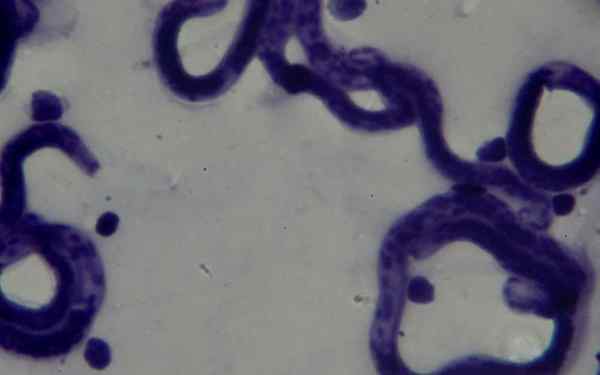
Nella macchia ematologica tinta di Giemsa, è possibile rilevare Borrelias sp Nei pazienti che studiano la malattia chiamata febbre ricorrente. Le spirequette sono osservate abbondanti tra gli eritrociti, in campioni prelevati nel picco febbrile.
È anche possibile visualizzare batteri intracellulari come Rickettsias sp E Chlamydia trachomatis Nelle cellule infette.
parassitologia
Nel campo della parassitologia, la colorazione di Giemsa ha permesso la diagnosi di malattie parassita.
Nei primi due, i parassiti Plasmodium sp e il Cruzi Tripaosoma, rispettivamente, possono essere visualizzati nel sangue periferico dei pazienti infetti. Possono essere trovati in varie fasi in base alla fase in cui è la malattia.
Per migliorare la ricerca di parassiti del sangue, si raccomanda.
Allo stesso modo, la leishmaniosi cutanea può essere diagnosticata quando si valutano campioni di biopsie in pelle tinte con Giemsa, dove si trova il parassita.
Citologia
La colorazione di Giemsa viene utilizzata anche per lo studio citologico dei campioni endocervicali, sebbene non sia la tecnica più frequentemente usata a questo scopo.
Ma in caso di scarsità di risorse, può essere utilizzato, con una funzionalità simile a quella offerta dal Pap Lake e un costo inferiore. Tuttavia, richiede competenze da parte dell'esame.
Citogenetica
Una caratteristica rilevante della colorazione di Giemsa è la sua capacità di unirsi fortemente alle regioni ricche di adenine e timiniche del DNA. Ciò consente di visualizzare il DNA durante la miitosi cellulare, in diversi stati di condensa.
Questi studi sono necessari per rilevare aberrazioni cromatiche, come duplicazioni, delezioni o traslocazioni delle diverse regioni dei cromosomi.
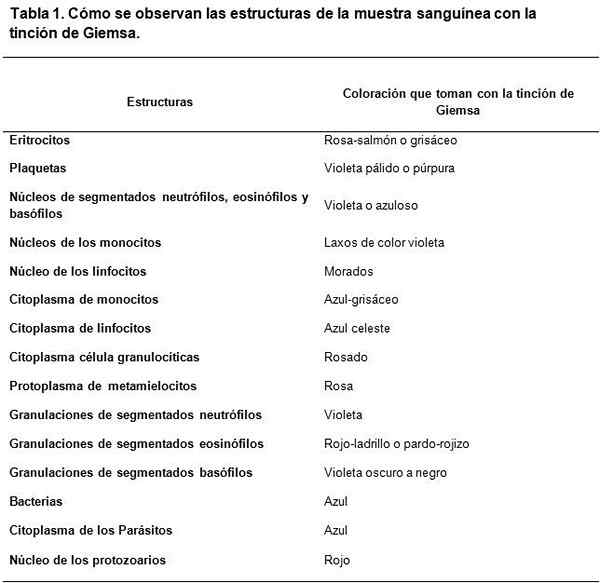 Colorazione Giemsa. Fonte: Panreac Applichem ITW Reagents. Versione 2: Jmbjul17 Ceivd10es. Castellar Del Vallés, Spagna.
Colorazione Giemsa. Fonte: Panreac Applichem ITW Reagents. Versione 2: Jmbjul17 Ceivd10es. Castellar Del Vallés, Spagna. Raccomandazioni per una buona colorazione
- L'essiccazione dei fogli non dovrebbe essere accelerata. Il tempo prudenziale per l'essiccata deve essere prevedibile all'aperto. Circa 2 ore.
Può servirti: Timina- Colorare immediatamente dopo 2 ore per risultati migliori.
- Affinché gli odori siano fissi e tinti meglio, il campione deve essere distribuito sul foglio in modo che vi sia uno strato sottile e uniforme.
- Il campione di sangue preferito è il capillare, dal momento che lo Smere.
- Se viene utilizzato il sangue venoso, EDTA dovrebbe essere usato come anticoagulante e non eparina, poiché quest'ultimo di solito deforma le cellule.
Errori comuni nella colorazione di Giemsa
Nella pratica di questa colorazione puoi fare errori. Sono evidenziati da improvvisi cambiamenti nelle tonalità delle strutture.
Colorazione estremamente blu
Potrebbe essere dovuto a:
- Striscio molto spesso.
- Superare il tempo di colorazione.
- Insufficiente lavare.
- Uso di reagenti ben al di sopra del pH neutro (alcalino).
In queste condizioni, i colori delle seguenti strutture sono distorti, in modo tale che gli eritrociti, invece di tingere il sale di rosa, N saranno verdi, i granuli degli eosinofili che devono essere tinti in mattoni rossi diventeranno bluastri o grigi o grigi o grigi o grigi o grigi o grigi o grigi o grigi grigio, e così via ci sarà una deviazione nelle solite tonalità.
Colorazione eccessivamente rosa
Potrebbe essere dovuto a:
- Tempo di colorazione insufficiente.
- Lavaggio prolungato o eccessivo.
- Essiccando male.
- Uso di reagenti molto acidi.
In questo caso particolare, le strutture che sono normalmente tinte in blu non saranno quasi visibili, mentre le strutture tinte come rosa avranno toni molto esagerati.
Esempio: gli eritrociti prendono un forte colore rosso brillante o arancione, la cromatina nucleare apparirà rosa pallido e i granuli eosinofili saranno tinti da rosso vivo brillante.
Presenza di precipitati nello striscio
Le cause possono essere:
- Usa fette sporche o cattive.
- Non lasciare che lo striscio si asciughi.
- Lascia la soluzione di fissaggio per troppo tempo.
- Lavaggio inadeguato alla fine della colorazione.
- Filtrazione inadeguata o non filtrazione del colorante utilizzato.
Presenza di artefatti morfologici
Negli strisci, possono apparire artefatti morfologici che ostacolano la visualizzazione e l'interpretazione delle strutture presenti. Questo è dovuto a:
- Tipo di anticoagulante usato, come l'eparina.
- Uso di fogli sporchi, deteriorati o grassi.
Modalità di archiviazione
Dopo aver preparato, il colorante deve essere mantenuto a temperatura ambiente (15-25 ° C), per impedire al colorante di precipitare. Deve essere conservato in un contenitore ambra ben chiuso.
Riferimenti
- Cannova, d., Brito, e. E Simons, M. (2016). Valutazione delle tecniche di colorazione per la diagnosi di leishmaniosi cutanea. Salus.
- Panreac Applichem Itw Reagni. Colorazione Giemsa. Versione 2: Jmbjul17 Ceivd10es. Castellar Del Vallés, Spagna.
- Clark, g. PROCEDURE DELLA STAGAZZA (1981). Williams e Willkins.

