Base acidali arrhenius, teorie della lowry bronsted, Lewis
- 662
- 83
- Zelida Gatti
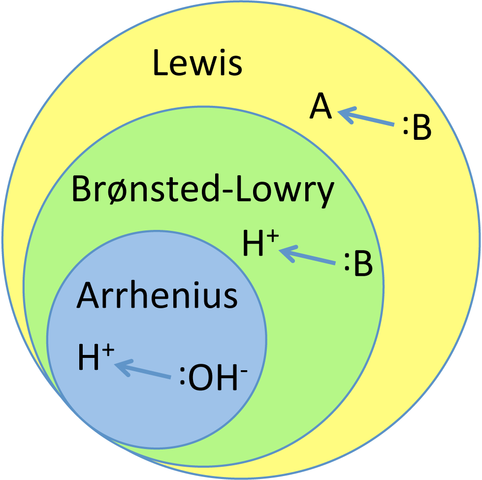
 Grafico che mette in relazione le tre principali teorie di acidi e basi. Fonte: Tem5psu, CC BY-SA 3.0, via Wikimedia Commons
Grafico che mette in relazione le tre principali teorie di acidi e basi. Fonte: Tem5psu, CC BY-SA 3.0, via Wikimedia Commons Cosa sono le teorie acide e di base?
Le teorie dell'acido e delle basi sono un insieme di contributi concettuali che definiscono e differenziano acidi e basi, due conglomerati di immense sostanze di rilevanza nei campi della chimica.
Le sue radici provengono dalle prime caratterizzazioni fatte da Robert Boyle nel 1661, che definirono acidi come sostanze acide e corrosive che cambiano il colore del blu a molla rossa; E le basi come le sostanze insaponate che, a differenza degli acidi, cambiano il colore della carta stinco rossa a blu.
Antoine Lavoisier ha proposto che tutti gli acidi contengano atomi di ossigeno, come H2SW4 e hno3. Secoli dopo nel 1811 Humphry Davy scoprì che molti acidi in realtà non possedevano atomi di ossigeno, come HCl, HF, HBR, ecc.
E poco prima dell'apparizione della famosa triade acida-base (immagine superiore), Justig Liebig ha suggerito che gli acidi hanno atomi di idrogeno che possono essere sostituiti dai cationi metallici.
Questa conoscenza empirica è stata ispirazione per le attuali teorie di acidi e basi: Arrhenius, Bronsted-Lowry e Lewis. Come visto nel grafico, la teoria di Arrhenius è la più restrittiva o limitata di tutti, mentre quella di Lewis è la più generale e globalizzata.
Teoria di Arrhenius
Proposto dal 1884 da Svante Arrhenius, la sua teoria afferma che gli acidi quando si dissolvono in acqua producono ioni H3O+ o h+; Mentre le basi, quando si dissolvono in acqua, producono o rilasciano ioni OH-.
Gli ioni h3O+ e oh- Si combinano in una reazione reversibile che dà origine a molecole d'acqua:
H3O+ + OH- ⇌ 2h2O
Può servirti: acido disolfurico: cosa è, struttura, proprietà, usiQuindi, un acido Arrhenius è anche quello che aumenta la concentrazione di ioni H3O+, Mentre una base di Arrhenius è quella che aumenta la concentrazione di ioni oh-.
Ciò significa che un acido arrhenius non dovrebbe necessariamente contenere ioni H3O+, E una base di Arrhenius non deve avere ioni oh- Nella sua struttura.
Esempio e limitazioni
Considera le seguenti dissociazioni:
HCl (AC) → H+(AC) +CL-(AC)
NaOH (AC) → Na+(AC) +OH-(AC)
HCl è un acido arrhenius perché quando viene sciolto in acqua produce ioni H+, o più correttamente, ioni H3O+. E d'altra parte, Naoh è una base di Arrhenius perché quando viene sciolta in acqua, OH ioni rilascia-. Queste sostanze reagiscono tra loro per produrre sale e acqua:
HCl (AC) + NaOH (AC) → NaCl (AC) + H2O
Il problema con la teoria di Arrhenius sta nel fatto che è limitato solo a soluzioni acquose, e quindi, si applica solo per sostanze solubili in acqua. Ad esempio, l'MGO è molto insolubile nell'acqua, eppure è un ossido di base.
Non è inoltre in grado di spiegare da sola come sostanze come NH3 e Cao produce ioni oh- sciolto in acqua, anche quando non hanno ioni oh- Nella sua struttura molecolare o cristallina (come nel caso di NaOH o KOH).
E non spiega come il CO2 può rilasciare ioni h3O+ In acqua senza avere atomo di idrogeno nella sua struttura molecolare (come nel caso di HCl o H2SW4).
Teoria di Brönsted-Lowry
Proposta individualmente nel 1923 di Johannes Bronsted e Thomas Lewry, la loro teoria degli acidi e delle basi afferma che un acido è tutta quella sostanza che può donare ioni h+, e che una base invece è qualsiasi sostanza che è in grado di accettare questi h+. Questa teoria è più generale di quella di Arrhenius e copre alcune delle sue limitazioni.
Può servirti: soluzioni molari: concetto, preparazione, esempiEsempio
Considera di nuovo l'equazione di neutralizzazione tra H3O+ e un oh- Per produrre due molecole d'acqua:
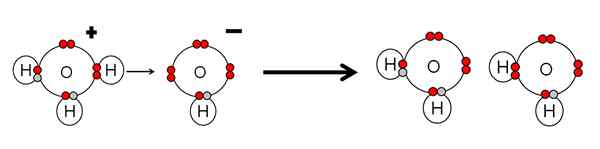 Esempio di neutralizzazione acida e base dell'acqua. Fonte: Gabriel Bolívar.
Esempio di neutralizzazione acida e base dell'acqua. Fonte: Gabriel Bolívar. Nota che h3O+ Fatto un h+ che immediatamente sarà collegato o coordinato con l'OH- giusto giusto. Quando h+ Termina collegata a una delle coppie senza elettroni dell'OH-, Rimangono due molecole di acqua neutra come prodotti.
Il h3O+ Pertanto è un acido a canottiere brnsted, per donare l'H+, E l'OH- È una base di lowry brnsted per accettare questa h+.
Un altro esempio di reazione acida-base è il seguente:
NH3(G) + HCl (G) → NH4CL (S)
Questa reazione, secondo Arrhenius, non può essere considerata il tipo di base acida perché non si verifica in mezzo acquoso ma nella fase del vapore o in uno stato gassoso. Il NH3 È una base Brnsted perché accetta l'HCL H donando un paio di elettroni situati sull'atomo di azoto; E l'HCl, logico, diventa l'acido brnsted.
Pertanto, il MGO è una base BRNSTED perché è in grado di accettare H+ di acidi da trasformare in mg (OH)2.
Teoria di Lewis
La teoria di Bronsted-Lowry spiega un ampio spettro di reazioni a base di acido. Tuttavia, ignora quelle reazioni in cui ioni H+ e oh- Non sono affatto coinvolti, così come una maggiore partecipazione di elettroni liberi nei meccanismi molecolari.
Quindi, nel 1923 g. N. Lewis ha proposto una teoria della base di acido che dice quanto segue: un acido è qualsiasi sostanza in grado di accettare coppie di elettroni, mentre una base è una che dona queste coppie di elettroni.
Può servirti: DAPI (4 ', 6-diamidino-2-fenilindolo): caratteristiche, fondazione, usoAd esempio, Ion H+ È un acido Lewis perché accetta coppie di elettroni di qualsiasi specie intorno: da H2O per avere origine h3O+, di NH3 Per avere origine NH4+, eccetera.
Esempio e vantaggi
Considera un altro esempio nella seguente reazione:
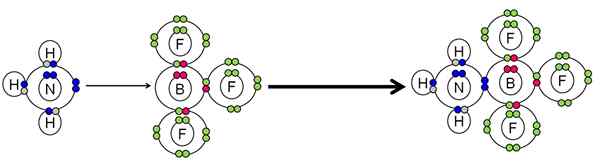 Esempio di neutralizzazione tra un acido e una base di Lewis. Fonte: Gabriel Bolívar.
Esempio di neutralizzazione tra un acido e una base di Lewis. Fonte: Gabriel Bolívar. Il NH3 Fatto una coppia di elettroni (blu) dell'atomo di azoto all'atomo BF Boron3. Pertanto, il NH3 È la base di Lewis perché dona la coppia di elettroni e il BF3 È l'acido di Lewis perché li accetta.
In generale, i cationi e le specie di elettroni poveri sono acidi Lewis, mentre gli anioni e le specie di elettroni sono basi di Lewis.
I vantaggi offerti.
Ad esempio: h2O Ha elettroni liberi nell'ossigeno. Se doni uno di loro a uno ione h+, fungerà da base di Lewis, essendo la H+ Di conseguenza l'acido Lewis.
Secondo Bronsted-Lowry, h2Oppure agirei come base perché accetta esattamente H+ Donando un paio di elettroni gratuiti. E infine, h2O è anche una base secondo la teoria di Arrhenius perché la concentrazione di ioni H sta diminuendo+ nell'ambiente acquoso e di conseguenza aumentando la concentrazione di ioni OH-.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Clark Jim. (2002). Teorie di acidi e basi. Recuperato da: ChemGuide.co.UK
- Broderick c., Moussa m., & Clark J. (21 agosto 2020). Panoramica di acidi e basi. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Wikipedia. (2020). Reazione acida-base. Recuperato da: in.Wikipedia.org
- Texas A&M University. (S.F.). Acidi e basi: sviluppo di acidi e basi. Recuperato da: Chem.Tamu.Edu

