Collegamento a ponte idrogeno
- 2757
- 572
- Zelida Gatti
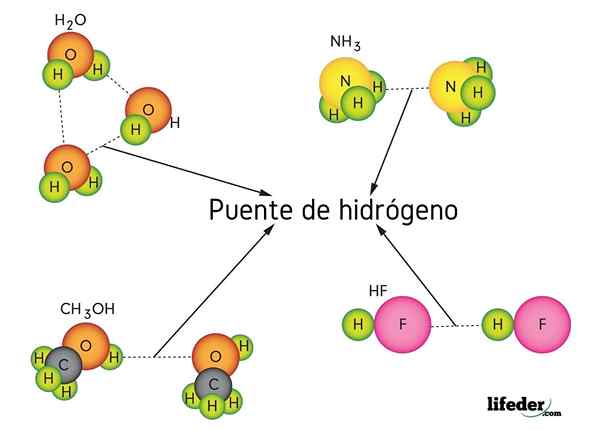
 Ponte idrogeno in acqua (H2O), metanolo (Cho3OH), idrogeno fluoruro (HF) e ammoniaca (NH3)
Ponte idrogeno in acqua (H2O), metanolo (Cho3OH), idrogeno fluoruro (HF) e ammoniaca (NH3) Cos'è un collegamento a ponte idrogeno?
Il legame con ponte idrogeno è un tipo speciale di interazione dipolo-dipolo, appartenente alle forze di van der Waals, in cui un atomo di idrogeno si unisce a due o più molecole senza essere legato in modo covalente. Non si parla di un compartimento elettronico, ma di un fenomeno principalmente elettrostatico.
Come suggerisce il nome, l'idrogeno funge da ponte, quindi deve essere tra due atomi. L'idrogeno è collegato (H-X) a un atomo molto elettronegativo (come N, O e F) e si avvicina a un altro atomo elettronegativo ma da una molecola vicina. Ciò si traduce nella formazione del ponte idrogeno X ··· H-X.
Si noti che nella rappresentazione X ··· H-X, i punti simboleggiano il ponte idrogeno, mentre la sceneggiatura rappresenta il legame covalente tra H e X. Detto questo, diamo un'occhiata al ponte idrogeno tra due molecole d'acqua, dove x è l'atomo di ossigeno: H2Oppure ··· H-OH (IMMAGINE inferiore).
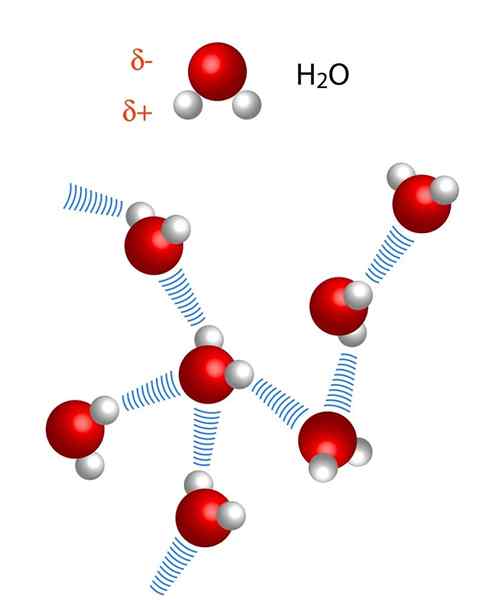
Nell'immagine sopra vediamo che sette molecole d'acqua rimangono insieme grazie ai loro ponti idrogeno, rappresentati da linee blu. Un solo ponte idrogeno non è molto forte, ma quando ce ne sono miliardi, danno proprietà anormali e inaspettate.
Caratteristiche del ponte idrogeno
Compositivo
Il ponte idrogeno dovrebbe essere davvero rappresentato come x '··· h-x, dove x è ciò che è noto come donatore di ponte idrogeno, perché è covalentemente legato all'idrogeno (lo dà).
Nel frattempo, X 'è l'accettore del ponte idrogeno, presente in una molecola vicina (la riceve). Pertanto, abbiamo un atomo di donatore (x), un idrogeno (H) e un atomo accettore (x ') che compongono il ponte idrogeno (X' ··· H-X).
Geometrico
Quando pensiamo a un ponte, mi vengono in mente le superfici piatte o arcuate. Poiché si presume che i collegamenti non si curvino, avremo quindi due distanze: x ··· h e h-x, che compongono il ponte idrogeno x ··· h-x.
Può servirti: reazione irreversibile: caratteristiche ed esempiTra queste due distanze c'è un angolo, che è spesso 180 °; Cioè, i tre atomi del nostro ponte poggiano sulla stessa linea orizzontale (o verticale).
Quando l'angolo è diverso da 180º, il ponte X ··· H-X non è più dritto o lineare, ma acquisisce altre geometrie.
D'altra parte, le distanze nei ponti idrogeno non sono identiche. La distanza H-X è più corta di x ··· h, che può essere vista nell'immagine delle molecole d'acqua. Pertanto, ad esempio, la distanza H-X è generalmente alle 110 (1 · 10-12m), mentre l'altra distanza x ··· h è 160 in poi.
Associativo
Una caratteristica speciale del ponte idrogeno è che consente alle molecole di essere molto più associate tra loro. Non camminano da un lato all'altro che si ignorano. Pertanto, stabilisce un ordine momentaneo nel seno dei liquidi; E nel caso dei solidi, contribuiscono alla definizione dei loro cristalli.
Dove vediamo un ponte idrogeno possiamo pensare all'associazione e, quindi, in un certo ordine (sebbene dinamico e cambio) su scale molecolari.
Energia
Rompere un ponte idrogeno non è molto difficile. Molecole d'acqua, ad esempio, camminano e creano ogni volta durante la mobilitazione. Ma rompere molti di loro allo stesso tempo implicherebbe disordinare un numero infinito di molecole. Parliamo di fornire tale energia che rompe le moli di questi ponti idrogeno (6.02 · 1023 X ··· H-X).
Pertanto, la forza del ponte idrogeno varia a seconda delle identità e della natura delle molecole. Ad esempio, la forza del ponte idrogeno o ··· H-O tra acqua e alcol è 5 kcal/mol: è necessaria 5 kcal di energia per rompere una mole di quel ponte idrogeno in questione.
Può servirti: cambiamenti chimici: caratteristiche, esempi, tipiEsempi di ponti idrogeno
Acqua
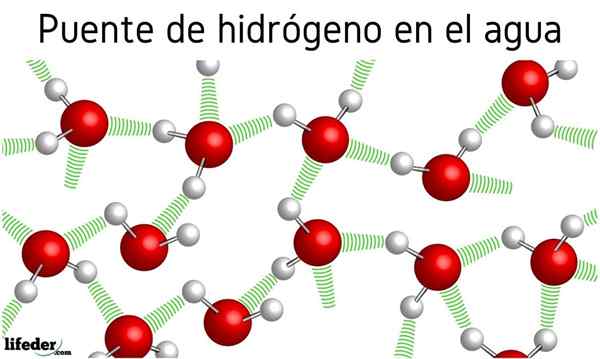
Inizialmente si parlava di ponti idrogeno tra le molecole d'acqua, ma l'effetto che ha sulle loro proprietà non è stato menzionato. Grazie a loro l'acqua bolle a 100 ° C, lasciando i punti di ebollizione delle molecole correlate come H2S, che bolle a -60 ºC; o h2Lo so, bollire a -41.25 ºC.
Questa differenza abissale è dovuta a ponti idrogeno d'acqua, che definiscono anche altre delle loro proprietà anomale, come il loro enorme calore specifico, cristalli di ghiaccio, la loro costante dielettrica, ecc.
Etanolo
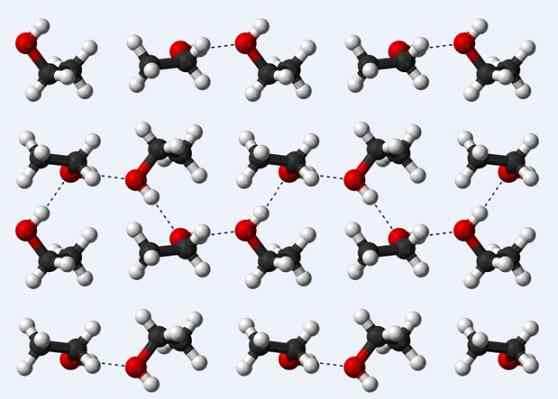 Ponti idrogeno in un cristallo di etanolo
Ponti idrogeno in un cristallo di etanolo Ora vediamo un altro ponte idrogeno: quello tra molecole di etanolo, CH3Cap2Oh (sopra). Nota come sono sistemate le molecole3Cap2Oh in modo tale che vengano stabiliti i loro ponti idrogeno3Cap2Ho ··· Hoch2Cap3 (linee tratteggiate).
Tuttavia, le molecole sono troppo ordinate per supporre che parliamo di etanolo liquido, ma invece costituiscono un vetro (etanolo solido).
Il ponte idrogeno descritto per l'etanolo è simile a quello degli altri alcoli, con la differenza che i loro scheletri carbonizzati possono ostacolare l'efficienza di tali ponti.
Acido acetico
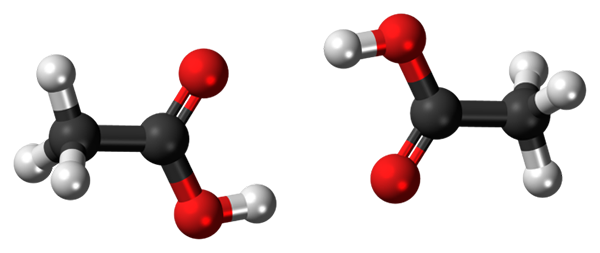 Ponti idrogeno tra due molecole di acido acetico. Fonte: Jynto, CC0, via Wikimedia Commons
Ponti idrogeno tra due molecole di acido acetico. Fonte: Jynto, CC0, via Wikimedia Commons Acido acetico, Cho3COOH, è in grado di stabilire due ponti idrogeno che uniscono due molecole contemporaneamente. Poiché sono due molecole collegate dai ponti idrogeno, parliamo di un dimero.
Si noti che uno di questi ponti idrogeno è C = O ··· H-O e l'altro O-H ··· O = C. L'acido acetico presenta la peculiarità che nella fase del vapore esiste come questo dimero.
Può servirti: acido manganico o permanganicoCellulosa
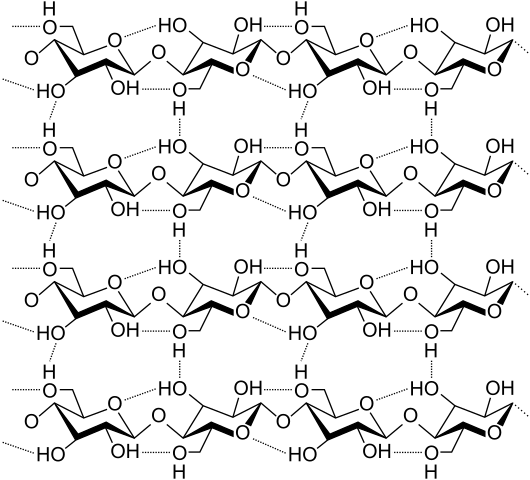 Ponti idrogeno tra diverse catene di cellulosa. Fonte: Laghi.L, CC BY-SA 3.0, via Wikimedia Commons
Ponti idrogeno tra diverse catene di cellulosa. Fonte: Laghi.L, CC BY-SA 3.0, via Wikimedia Commons Vediamo ora ponti di idrogeno più diversi e multipli. La cellulosa, un polimero naturale, è costituita da catene composte da diverse unità di β-glucosio.
Ogni catena rimane fissata ad un'altra grazie a molti ponti idrogeno (immagine superiore), che rafforzano la coesione tra le catene.
DNA
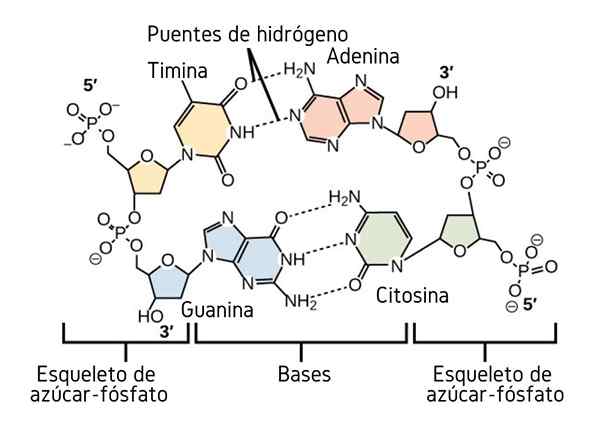 Ponti idrogeno tra le basi di azoto del DNA. Fonte: CNX OpenStax, CC di 4.0, via Wikimedia Commons
Ponti idrogeno tra le basi di azoto del DNA. Fonte: CNX OpenStax, CC di 4.0, via Wikimedia Commons Finora abbiamo visto l'effetto associativo dei ponti idrogeno per imporre l'ordine tra le molecole. Ma che dire di una macromolecola? In una macromolecola, come il DNA, troviamo ponti idrogeno interni o intramolecolari tra la sua base di timina, adenina, guanina e citosina (sopra) (sopra).
I ponti idrogeno intramolecolari tra queste coppie di basi di azoto, fanno acquisire la molecola di DNA una struttura a doppia elica, ideale per la sua replicazione. Se questi ponti idrogeno sono rotti dal riscaldamento, la doppia elica finirà per aprirsi in due singoli segmenti o bande.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Edward E. Ávila e Asilé J. Mora. (2004). Il ponte idrogeno e le sue applicazioni si collegano. Università di Los Ande, Facoltà di Scienze, Dipartimento di Chimica.
- Wikipedia. (2020). Legame idrogeno. Recuperato da: in.Wikipedia.org
- Pietri J. & Clark J. (21 agosto 2020). Legame idrogeno. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- I redattori di Enyclopedia Britannica. (2020). Legame idrogeno. Recuperato da: Britannica.com
- Helmestine, Anne Marie, PH.D. (29 ottobre 2020). Cosa sono l'esempio di legame idrogeno? Recuperato da: Thoughtco.com

