Struttura di bromuro di potassio (KBR), proprietà, usi
- 3885
- 634
- Baldassarre Ross
Lui bromuro di potassio È un sale inorganico la cui formula chimica è KBR. È formato dall'unione elettrostatica di un anione bromuro, BR-, E un catione di potassio, k+, in una proporzione 1: 1; Cioè, abbiamo la stessa quantità di BR- a partire da k+ Nei cristalli KBR.
Il bromuro di potassio è un sale bianco o cristallino solido, è inodore, molto solubile in acqua e poco solubile in etanolo ed etanolo. Fu usato durante la parte finale del XIX secolo e gran parte del ventesimo secolo nel trattamento dell'epilessia e come sedativo.
Fino al 1975 ha continuato a vendere liberamente, l'anno in cui il suo uso è diminuito a causa degli effetti tossici che ha prodotto sui pazienti. Attualmente è ancora usato in diverse specie di animali nel trattamento delle convulsioni, sebbene dal 1912 sia stato sostituito dal fenobarbitale di sodio.
Il bromuro di potassio viene utilizzato in studi ottici corrispondenti alla vicina regione a infrarossi dello spettro elettromagnetico. Funge anche da materiale utilizzato nel campo della fotografia.
[TOC]
Tipo di collegamento
Il bromuro di potassio è un sale binario, prodotto della combinazione di un atomo di bromo con uno stato di ossidazione -1, con un atomo di potassio con uno stato di ossidazione +1. Pertanto, viene stabilita un'attrazione elettrica tra l'ione BR- E lo ione k+.
Questo tipo di interazione elettrica o elettrostatica è noto come un legame ionico, che si dissocia quando il sale bromuro di potassio si dissolve nell'acqua, rilasciando gli ioni K+ e br-.
Questi ioni sono disintegrati dai proprietari di acqua.
Struttura del bromuro di potassio
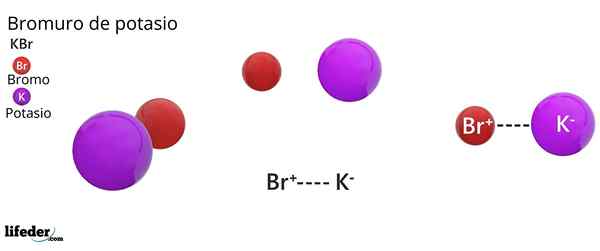
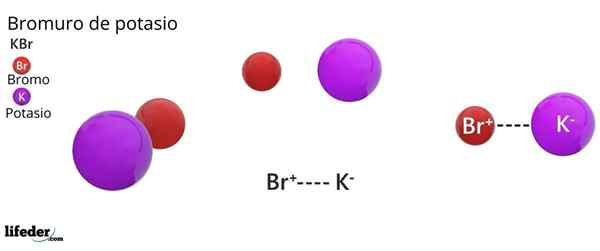
 Struttura cristallina FCC del KBR: le sfere marroni corrispondono al br-, mentre le sfere violari corrispondono ai cationi k+
Struttura cristallina FCC del KBR: le sfere marroni corrispondono al br-, mentre le sfere violari corrispondono ai cationi k+ Il bromuro di potassio presenta una struttura cristallina cubica centrata sul viso (FCC) Cubico centrato sul viso), uguale a quello osservato nel cloruro di sodio.
Può servirti: Faraday CostantIn questa struttura, ogni anione br- È collegato o coordinato con sei cationi K+, E a sua volta, ogni k+ Ha sei br- come vicini in reti cristalline.
Nomenclatura
Il bromuro di potassio è classificato come alogenuro di alogenuri o metallo alcalino. I nomi di questi sali sono costruiti eliminando l'ultima lettera del nome dell'alogeno (cloro, bromo, iodio, fluoro e Astato), ad eccezione del fluoro e sostituendo la lettera finale con il suffisso -uro. Il nome del metallo è scritto di seguito senza modifiche.
Ad esempio: cloruro di sodio, ioduro di potassio, fluoruro di calcio, ecc. Ecco perché il KBR si chiama bromuro di potassio o bromuro di potassio (secondo la tradizionale nomenclatura).
Proprietà bromuro di potassio
 Disco di orologio con granuli KBR. Fonte: Walkerma via Wikipedia.
Disco di orologio con granuli KBR. Fonte: Walkerma via Wikipedia. Aspetto fisico
Vetro incolore, granuli cristallini o bianchi.
Odore
Gabinetto
Gusto
Ad un'alta concentrazione ha un gusto amaro e piccante.
Massa molare
119.02 g/mol
Densità
2.74 g/cm3 a 25 ºC
Punto di fusione
734 ºC
Punto di ebollizione
1435 ºC
Solubilità dell'acqua
535 g/l a 0 ºC
678 g/l a 25 ºC
1020 g/l a 100 ºC
1 grammo di sale viene sciolto in 1 ml di acqua bollente, il che indica che è molto solubile in acqua.
Solubilità in glicerolo
217 g/l
1 grammo di bromuro di potassio si dissolve in 4.6 ml di glicerolo.
Solubilità dell'etanolo
47.6 g/l a 80 ºC.
1 grammo di bromuro di potassio si dissolve in 250 ml di etanolo.
Densità del vapore
7.14 Nella relazione aerea presa come unità.
Stabilità
Stabile se immagazzinato nelle condizioni raccomandate. Incompatibile con agenti ossidanti, acidi forti, bromo trifluoruro e bromo.
Decomposizione
Se riscaldato alla decomposizione emette prodotti dannosi, come bromuro di idrogeno e ossido di potassio.
Può servirti: configurazione elettronica del kernel: costruzione, esempiIndice di rifrazione (ND)
1.559
ph
In soluzione acquosa produce un pH neutro, circa 7.
punto di accensione
1435 ºC
Dissoluzione e reattività
In soluzione acquosa il KBR è completamente dissociata per causare una soluzione di pH neutra.
Il sale è una fonte di bromuro che può essere utilizzato per la produzione di bromuro d'argento, AGBR, composto utilizzato nello sviluppo di fotografie:
KBR (AC) +AGNO3 (AC) → Agbr (S) +Kno3 (AC)
Inoltre, il KBR è un agente riducente debole, incompatibile con mercurio e sali d'argento. Produce una reazione violenta con bromo trifluoruro. Può reagire con molti sali, alcaloidi e amido.
Reagisce anche con gli acidi, ad esempio, con acido solforico concentrato, rilasciando bromide idrogeno.
Applicazioni
Trattamento dell'epilessia e delle convulsioni
Le proprietà anticonvulsive del bromuro di potassio furono esposte per la prima volta da Sir Charles Locock, in una riunione della Royal Medicine and Chirurgical Society nel 1857, che promuoveva il suo uso nel trattamento dell'epilessia.
Il bromuro di potassio fu usato come farmaco prioritario nel trattamento dell'epilessia e come sedativo fino al 1912, quando fu annunciato il fenobarbitale di sodio.
Anche così, è stato continuato ad essere usato come complemento al fenobarbital di sodio nel trattamento delle convulsioni dell'epilessia.
Nell'anno del 1975, a causa del suo carattere tossico, la FDA U.S. (Food & Drug Administration) ha deciso di non raccomandare l'uso di bromuro di potassio, sia nell'uomo che negli animali. Tuttavia, alcuni paesi hanno continuato a amministrarlo.
Il bromuro di potassio è stato usato come ipnotico e sedativo in bovini, cavalli, pecore e maiali. È stato anche usato nel trattamento di coliche e tetania nei cavalli e nel trattamento delle convulsioni nei cani.
Ottica a infrarossi
A causa della trasparenza del bromuro di potassio in una gamma di lunghezze d'onda tra la luce ultravioletta e il vicino infrarosso, viene usato come componente delle finestre per diverse radiazioni elettromagnetiche, in particolare radiazioni a infrarossi.
Può servirti: osmolaritàVengono utilizzate diverse tecniche. Uno di questi consiste nell'elaborazione di due dischi cristallini di bromuro di potassio, mettendo un film del materiale da analizzare nell'infrarosso negli album. Gli studi sono condotti nel vicino infrarosso tra 780 nm e 3000 nm.
Fotografia
 Il KBR faceva parte dei materiali utilizzati per elaborare le prime fotografie del ventesimo secolo
Il KBR faceva parte dei materiali utilizzati per elaborare le prime fotografie del ventesimo secolo Il bromuro di potassio ha avuto numerosi usi e applicazioni in fotografia, ad esempio: è stato utilizzato per formulare gli sviluppatori di fotografia, nella produzione di film fotografici, come spessore di film e come candeggina a colori di colore.
Viene utilizzato nel miglioramento della differenziazione tra i cristalli di alogenuri d'argento esposti e non esposti, in aumento della densità di stampa di sottili negativi e come alogenuro secondario, in combinazione con iodidi, per l'elaborazione di carta negativa su carta.
È stato anche usato in combinazione con bicloruro di mercurio, solfato di rame o potassio ferricianurio nelle gradinate fotografiche. Ha anche servito come limitatore negli sviluppatori alcalini utilizzati per piastre di gelatina e documenti di sviluppo.
Analisi chimica
Il KBR viene utilizzato per determinare la valutazione del rame e dell'argento, nell'analisi polarografica degli indiani, del cadmio e dell'arsenico.
Altri usi
È usato nei processi di incisione della litografia, nella lavorazione dell'olio, nella stabilizzazione termica del nylon, nella produzione di fibre e infine nella produzione di saponi speciali.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Giorno, r., & Underwood, a. (1986). Chimica analitica quantitativa (Quinto ed.). Pearson Prentice Hall.
- Wikipedia. (2020). Bromuro di potassio. Recuperato da: in.Wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2021). Bromuro di potassio. Pubchem Comunund Sommario per CID 253877. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Emea. (1999). Bromuro, sale di potassio: rapporto di riepilogo. [PDF]. Recuperato da: EMA.Europa.Unione Europea
- Sevier b.V. (2020). Bromuro di potassio. Scienceirect. Estratto da: ScienceDirect.com

