Meccanismo di sostituzione elettrofila aromatica ed esempi

- 4145
- 967
- Dott. Rodolfo Gatti
IL Sostituzione elettrofila aromatica (Sear) È una reazione organica in cui una specie povera negli elettroni, cioè un'elettrofia, sostituisce uno degli idrogeni di un anello aromatico. Questa reazione è contraria alle aggiunte subite dagli alcheni, dimostrando l'effetto dell'aromaticità sulle reattività del benzene e dei suoi derivati.
L'elettrofilo, molte volte, viene generato durante lo stesso meccanismo molecolare, il prodotto della miscela dei reagenti e un catalizzatore, che consiste in un acido di Lewis, per esempio3 o fecl3. Questi catalizzatori aumentano l'avidità dell'elettrofilo dagli elettroni dell'anello aromatico, accelerando così la reazione.
 Nella sostituzione elettrofila aromatica è l'anello di benzene che attacca l'elettrofilo. Fonte: Gabriel Bolívar via Molview.
Nella sostituzione elettrofila aromatica è l'anello di benzene che attacca l'elettrofilo. Fonte: Gabriel Bolívar via Molview. Nell'immagine superiore abbiamo una semplice rappresentazione dell'attacco elettrofilo del benzene verso l'elettrofilo e+. Si noti che l'attacco proviene dagli elettroni di uno dei suoi doppi legami; Cioè, sono gli elettroni del sistema π coniugato che iniziano la scoria.
Questa reazione consente a benzene e altri composti aromatici di acquisire sostituenti come i gruppi OH, non2, SW3H, Cl, Br, R, Cor, Coch3, tra gli altri. Ad esempio, il fenolo viene sintetizzato tramite Sear a partire dal benzene e altri derivati.
[TOC]
Meccanismo di sostituzione elettrofila aromatica
Passaggio 1: attacco elettrofilo
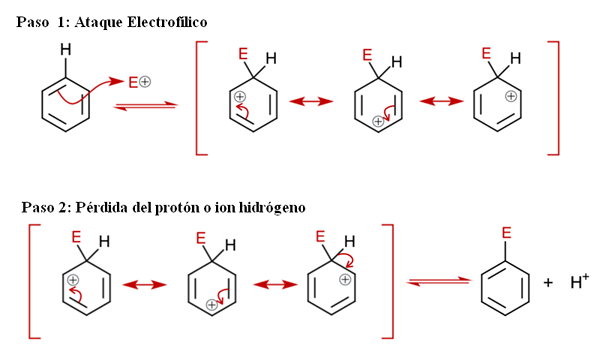 Meccanismo generale per Sear. Fonte: Soonlorpai via Wikipedia.
Meccanismo generale per Sear. Fonte: Soonlorpai via Wikipedia. Nell'immagine superiore il meccanismo della sostituzione elettrofila aromatica è rappresentato in modo più dettagliato. Uno dei tre doppi legami di benzene attacca l'elettrofilo e+, Formare una specie intermedia nota come ione Arenio (Cyclohexadien delocalizzato), bloccata tra parentesi rosse.
Può servirti: precipitazioni chimicheSi noti che il carico positivo di E+ Ora spostati all'interno dell'anello. Ma non solo: si trasferisce tra tre atomi di carbonio in posizioni orto (adiacenti) e per (opposto) al carbonio collegato a E (C-E). Questo intermediario esiste proprio grazie alla stabilità conferita dalle sue strutture di risonanza.
Passaggio 2: perdita del protone o dell'idrogeno
Tuttavia, lo ione Arenio deve presto neutralizzare il suo carico positivo perdendo un protone di idrogeno o uno ione. È qui che culmina la sostituzione. L'elettrofilo e+ quindi sostituisce uno degli idrogeni di benzene, lasciando questo come ione h+ Fuori dal ring, in modo che vengano conservate cariche positive.
Se si osserva attentamente, tutti i passaggi sono in equilibrio, quindi la sostituzione è reversibile. Cioè, se le concentrazioni di h sono aumentate+, quindi un idrogeno sostituirà E e otterrà di nuovo i reagenti.
Esempi di sostituzione elettrofila aromatica
Benzene
La bruciatura del benzene è la più semplice di tutte, già rappresentata sopra. Uno degli idrogeni può essere sostituito da E+, Perché tutti sono chimicamente equivalenti.
Non ci sono differenze l'una dall'altra. Pertanto, la probabilità che la sostituzione si verifichi in uno dei sei atomi di carbonio è la stessa. Tuttavia, tutto cambia quando ci sono altri sostituenti presenti nell'anello benzenico, come vedremo di seguito.
Fenolo
Orto, per e attacchi di obiettivi
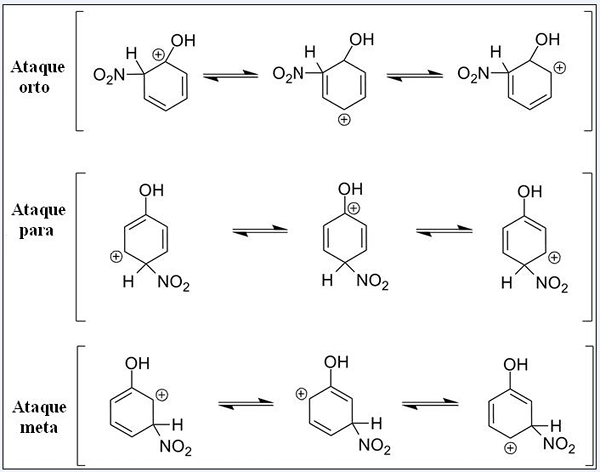 Strutture di risonanza per fenolo nella sua reazione di sostituzione elettrofila aromatica. Fonte: Pete Davis, dominio pubblico, via Wikimedia Commons
Strutture di risonanza per fenolo nella sua reazione di sostituzione elettrofila aromatica. Fonte: Pete Davis, dominio pubblico, via Wikimedia Commons Considera ora la scoria per il fenolo. Questa volta, l'elettrofia è il catione nitroniano, no2+, che quando si collega all'anello del benzene viene trasformato nel gruppo nitro, -No2.
Può servirti: nitrati: proprietà, struttura, nomenclatura, formazioneOra che è presente un gruppo OH, gli altri idrogeni cessano di essere chimicamente equivalenti; Alcuni sono più sensibili all'essere sostituiti di altri. E inoltre, OH esercita un'influenza diretta a questo punto.
UP abbiamo tre sostituzioni in diverse posizioni relative a OH: Ortho Attacks, per e goal. Si noti che in tutti e tre abbiamo il catione sabbioso e le sue strutture di risonanza. Negli attacchi orto e per, il carico positivo all'interno dell'anello di benzene si trova proprio nel carbonio collegato a OH; Mentre nell'attacco bersaglio, questo non accade.
Oh come gruppo orto e per il regista
Oh presenta la capacità di cedere elettroni all'anello tramite risonanza e induzione. In entrambi, può aiutare a "dissipare" il carico positivo nel carbonio con cui è collegato, stabilizzando di conseguenza la struttura. Al contrario, quando si verifica l'attacco bersaglio, OH non può stabilizzare il carico positivo allo stesso modo, la struttura è più instabile.
Pertanto, gli attacchi orto e per più energia favoriti. Si dice quindi che OH è un gruppo di regista orto, che può anche attivare l'anello benzenico verso Sear. Cioè, il fenolo reagisce molto più velocemente del benzene, che è dimostrato misurando le velocità di reazione.
Arilamina
 Strutture di risonanza per anilina nella sua reazione di sostituzione elettrofila aromatica. Fonte: V8rik presso l'inglese Wikipedia, CC BY-SA 3.0, via Wikimedia Commons
Strutture di risonanza per anilina nella sua reazione di sostituzione elettrofila aromatica. Fonte: V8rik presso l'inglese Wikipedia, CC BY-SA 3.0, via Wikimedia Commons Il caso delle arilamine, come quella dell'anilina (immagine superiore), è simile a quello del fenolo. Si noti che nel suo meccanismo questa volta la stabilizzazione del carico positivo sull'atomo di azoto (H2N+=), aiutando la sostituzione ad essere orientata verso le posizioni orto e per, come con l'OH.
Può servirti: teorie del basso acido: arrhenius, bronsted-lowry, LewisOra, l'anilina è più reattiva del fenolo contro la sostituzione elettrofila. Perché? Perché l'atomo di azoto è meno elettronegativo di quello dell'ossigeno, motivo per cui dà la sua coppia di elettroni liberi più facilmente sull'anello aromatico. Ossigeno, poiché è più elettronegativo, produce una delle sue coppie di elettroni con meno "avidità".
Inoltre, il raggio atomico dell'azoto è più vicino a quello del carbonio. Ciò ha un impatto sul fatto che la risonanza avviene soprattutto tra atomi con radio o dimensioni simili. Pertanto, la risonanza tra carbonio e azoto è un po 'più stabile ed efficiente di quella tra carbonio e ossigeno.
Clorobenzene
Nel clorobenzene, d'altra parte, l'atomo di Cl rallenta la sostituzione dovuta alla sua elettronegatività. E sebbene sia anche in grado di donare elettroni a causa della risonanza all'anello, il suo raggio atomico è considerevolmente più grande di quello del carbonio, diminuendo quindi detto contributo elettronico.
In risposta, il clorobenzene reagisce 50 volte più lento del benzene, poiché il suo anello è disattivato a causa del cloro. E anche, attirando elettroni verso se stessi, il cloro è un gruppo target, quindi le sostituzioni si verificheranno principalmente in quella posizione.
Riferimenti
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. (10th Edizione.). Wiley Plus.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Morrison e Boyd. (1987). Chimica organica. (Quinta edizione). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Composto aromatico. Recuperato da: in.Wikipedia.org
- Ed Vitz et al. (8 settembre 2020). Idrocarburi aromatici. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Wyman Elizabeth. (2020). Idrocarburi aromatici: definizione, esempio e uso. Studio. Recuperato da: studio.com
- Boluda, c. J., Macías, m., & González Marrero, J. (2019). La complessità chimica della benzina automobilistica. Scienza, ingegneria e applicazioni,2(2), 51-79. Doi: doi.org/10.22206/CYAP.2019.V2i2.PP51-79
- « Caratteristiche energetiche termiche, ottenendo, trasferimento
- Struttura dell'ossido di alluminio, proprietà, usi, nomenclatura »

