Struttura dell'ossido di alluminio, proprietà, usi, nomenclatura
- 2343
- 284
- Ruth Cattaneo
Lui ossido di alluminio, Chiamato anche alumina, ossido di alluminio, corindon o triossido di alluminio, è un composto inorganico la cui formula chimica è per il2O3. È un ossido anfotero, sebbene possa diventare, a causa del trattamento, un composto quasi inerte.
Ha una grande durezza, resistenza alla corrosione e alta resistenza elettrica. Queste proprietà, tra le altre, hanno permesso all'ossido di alluminio di avere numerose applicazioni, come: isolamento elettrico, materiale abrasivo, protesi ossei e denti, ecc.
La bauxite è la fonte principale per ottenere ossido di alluminio. Il Corindon, d'altra parte, è un minerale di ossido di alluminio che è in stato libero sotto forma di α-al2O3. Il Corindon ha una durezza di 9.0, e a causa di alcune impurità, produce pietre preziose, come Sapphire e Ruby.
L'elettrolisi dell'ossido di alluminio serviva da base per l'isolamento in alluminio di Humphry Davy nel 1808. Questo stesso metodo, con alcuni adattamenti, è attualmente utilizzato nella produzione di alluminio metallico.
[TOC]
Struttura
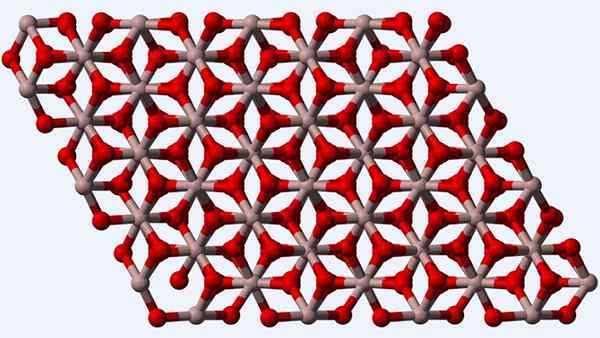 Struttura cristallina della fase α-al2O3 o Corindon
Struttura cristallina della fase α-al2O3 o Corindon Il corindon o la fase α-al2O3, Poiché è polimorfo termodinamicamente più stabile per l'ossido di alluminio, la sua struttura (immagine superiore) è considerata la principale al momento della sua caratterizzazione. Questa struttura è trigonale, con gli ioni al3+ circondato da sei o2-, e quindi, stabilire Octaedros al6 con interazioni al-o u al-o.
Oltre al Corindón, Al2O3 Esiste anche come altri polimorfi metastabili, tra cui: γ-al2O3 e η-al2O3 (cubico), θ-at2O3 (monoclinico), χ-al2O3 (esagonale), κ-al2O3 (Ortorrombico) e Δ-al2O3 (Tetragonale o ortorrombico).
Come al2O3, Gli ottaedri stanno "rompendo" in Tetraedros al4 o Pentaedros alo5. Una volta fuso e fresco di nuovo, è possibile ottenere un ossido di alluminio vitreo, cioè amorfo, con miscele di poliedri alm5 e tutto6.
Può servirti: Einsenio (S): struttura, proprietà, ottenimento, usiProprietà di ossido di alluminio
 Ossido di alluminio rivestimento in metallo fuso in alluminio
Ossido di alluminio rivestimento in metallo fuso in alluminio Aspetto fisico
Polvere cristallina solida o bianca
Massa molare
101.96 g/mol
Odore
Gabinetto
Densità
3.798 g/cm3
Punto di fusione
2072 ºC
Punto di ebollizione
2977 ºC
Solubilità
Insolubile in tutti i solventi, inclusa l'acqua.
Conduttività termica
30 w · m-1· K-1. Nonostante il suo uso ceramico, ha una conducibilità termica relativamente elevata.
Indice di rifrazione
1.768-1.760
Durezza
È un composto che presenta una durezza molto elevata, con un valore di 9.0 sulla scala di durezza MOHS sotto forma di ossido di α-alluminio (Corindón).
Resistività elettrica
A 300 ° C: 1.2 x 1013 Ohm · cm. L'ossido di alluminio o allumina è quindi un isolante elettrico.
Reattività
Al2O3 Nonostante reagi debolmente con gli alcali e, in misura maggiore, con gli acidi, è considerato un anfoter chimico. Tuttavia, quando viene riscaldato a più di 800 ° C, acquisisce uno stato quasi inerte all'azione degli acidi.
Questo ossido è responsabile della protezione dell'alluminio davanti agli agenti corrosivi ambientali, in quanto copre saldamente la superficie del metallo senza sbriciolare o crack.
Nomenclatura
La nomenclatura di al2O3 è semplice. Sistematicamente noto come triossido di diauminio. Poiché esiste questo ossido di alluminio, nella sua nomenclatura di serie il valencia metallica (III) non è specificato. Inoltre, il suo nome è tradizionalmente riassunto in ossido di alluminio, avendo solo una valenza.
Usi/applicazioni
Bicchiere
L'ossido di alluminio interviene nell'elaborazione del vetro di alluminio-silicato. Questo vetro refrattario, resistente allo shock termico, può essere utilizzato a temperature più elevate rispetto al vetro-silicato di boro; Sebbene abbia una resistenza chimica inferiore.
L'aggiunta di una piccola quantità di magnesia trasforma il vetro opaco di allumina in traslucido, essendo in grado di essere utilizzato come contenitore a gas nelle lampadine vapore di sodio ad alta pressione. Viene anche utilizzato nella preparazione di sospensioni di rivestimento di alcuni tipi di lampade fluorescenti.
Può servirti: rodio: storia, proprietà, struttura, usi, rischioCatalizzatore
L'allumina attivata ha una caratteristica granulare e porosa che può avere attività catalitica o fungere da supporto per l'attività di altri catalizzatori. Tra gli altri processi, l'allumina interviene nella catalisi della polimerizzazione dell'ossido di etilene.
Attività microbicida
Le particelle di ossido di nano-alluminio aderiscono alla superficie dei batteri, causando la loro morte. Allo stesso modo, è stato evidenziato un effetto simile sul fungo del genere Candida.
Isolante elettrico
L'ossido di alluminio ha un'alta resistività elettrica, il che gli dà la capacità di agire come isolante elettrico. Pertanto viene utilizzato nei pacchetti di circuiti integrati. Viene anche utilizzato nei dispositivi superconduttori e come condensatore dielettrico o condensatori. Inoltre, viene utilizzato come isolante in candele elettriche.
Abrasivo
 Il Corindon, il cristallino e più duro dell'ossido di alluminio, serve a costruire strumenti abrasivi. Fonte: Rob Lavinsky, Irocks.Com-CC-BY-SA-3.0, CC BY-SA 3.0, via Wikimedia Commons
Il Corindon, il cristallino e più duro dell'ossido di alluminio, serve a costruire strumenti abrasivi. Fonte: Rob Lavinsky, Irocks.Com-CC-BY-SA-3.0, CC BY-SA 3.0, via Wikimedia Commons L'elevata durezza del minerale di Corindon consente di essere usato come abrasivo, con meno costi dei diamanti, nell'industria e nella perforazione petrolifera.
Il Corindon acquisisce la preziosa forma di pietra, come il rubino rosso, a causa della contaminazione cromata; o come blu sapphire, a causa dell'inquinamento da ferro e titanio. Molti tipi di carta vetrata usati in metallo e legno hanno cristalli di ossido di alluminio.
Tenacia o capacità di evitare la rottura dell'ossido di alluminio aumenta con l'aggiunta di zirconia o carburo di silicio, che lo consente di essere utilizzato negli strumenti industriali di taglio. Inoltre, l'ossido di alluminio viene utilizzato nelle creme dentali per la lucidatura dei denti.
Può servirti: cromato di zinco: struttura, proprietà, ottenimento, usiAnche alcune presentazioni di ossido di alluminio sono usate come abrasive dai dermatologi nel trattamento di determinate condizioni cutanee.
Deumidificatore a gas
L'ossido di alluminio è un composto con avido dall'acqua, quindi può essere usato per estrarlo da correnti gassose.
Ritardante di fiamma
Le nano-particelle di idrossido di ossido di alluminio (Bohemita) fungono da dissipatore di calore, rilasciando acqua e ritardando l'aspetto delle fiamme.
Impianti di tessuto duro
L'ossido di alluminio è un composto di grande durezza, chimicamente inerte e resistente alla corrosione, oltre ad avere un colore bianco. Per queste qualità è usato come sostituto di tessuti duri come ossa e denti. Allo stesso modo, il materiale costruito con ossido di alluminio è stato utilizzato nella sostituzione delle articolazioni.
Ottenimento
 Campione di bauxite. Fonte: max.Kit, CC BY-SA 4.0, via Wikimedia Commons
Campione di bauxite. Fonte: max.Kit, CC BY-SA 4.0, via Wikimedia Commons La bauxite è il minerale principale per ottenere ossido di alluminio, essendo formato dalla miscela di tre minerali: gibbsite, laboehmita e diaspora.
L'ossido di alluminio viene estratto dai suoi minerali dalla procedura Bayer. Ciò consiste nella reazione di bauxite calda con idrossido di sodio, una reazione prodotta dall'alluminato di sodio [Naal (OH)4".
Quando la soluzione precedente viene raffreddata, la precipitazione dell'idrossido di alluminio viene prodotta in forma solida. Quindi questo idrossido viene riscaldato fino a 1100 ° C, producendo ossido di alluminio.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2020). Alluminio di ossido. Recuperato da: in.Wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2020). Alluminio di ossido. Pubchem Comunund Riepilogo per CID 9989226. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Kushagri s. et al. (2019). Potenzialità antivirale e antimicrobica dei farmaci nano: ossido di alluminio di nanoparticelle. Estratto da: ScienceDirect.com
- I redattori di Enyclopedia Britannica. (2020). Alumina. Recuperato da: Britannica.com
- Lohninger Hans. (15 agosto 2020). Alluminio di ossido. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- « Meccanismo di sostituzione elettrofila aromatica ed esempi
- 30 esempi di etica e morale nella vita quotidiana »

