Struttura di solfato di rame (CUSO4), proprietà, ottenimento, usi
- 2583
- 320
- Ruth Cattaneo
Lui solfato di rame È un composto inorganico formato da elementi di rame (Cu), zolfo (S) e ossigeno (O) (O). La sua formula chimica è Cuso4. Il rame è in uno stato di ossidazione +2, zolfo +6 e ossigeno ha Valencia -2.
È un solido bianco che quando è esposto all'umidità dell'ambiente diventa il suo pentaidrato blu cuso4 •5h2O. Il solido bianco si ottiene riscaldando il blu per eliminare l'acqua.
 Rame solfato (CUO4) anidro (senza acqua nella sua struttura cristallina). W. Oelen/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons.
Rame solfato (CUO4) anidro (senza acqua nella sua struttura cristallina). W. Oelen/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons. È stato usato come agente antibatterico per secoli per curare le ferite nell'uomo e negli animali. Funziona anche come un fungicida, come un astringente, antidiarheal e controlla le malattie intestinali negli animali. Viene anche usato come agente antihongos nelle piante.
Tuttavia, alcuni dei loro usi sono stati interrotti perché il loro eccesso può essere tossico sia per l'uomo, gli animali che per le piante. L'intervallo delle concentrazioni in cui può essere utilizzato è stretto e dipende dalla specie.
È usato come catalizzatore nelle reazioni chimiche e come solventi essiccanti. Permette di migliorare la resistenza e la flessibilità di alcuni polimeri.
Quantità eccessive di questo composto possono essere dannose per i terreni, poiché è tossico per i microrganismi benefici per le piante.
[TOC]
Struttura
Il solfato di rame è formato da uno ione di rame (Cu2+) e uno ione solfato (SO42-).
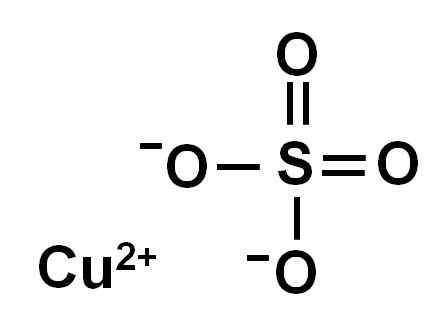 Ionica rame solfato (II). Autore: Marilú Stea.
Ionica rame solfato (II). Autore: Marilú Stea. A causa della perdita di due elettroni, lo ione di rame (II) ha la seguente conformazione elettronica:
1s2 2s2 2 p6 3s2 3p6 3d9
Si può vedere che l'orbitale ha 3d incompleto (ha 9 elettroni anziché 10).
Nomenclatura
- Solfato di rame anidro
- Rame solfato (ii)
- Solfato cuprico
Proprietà
Stato fisico
Solido bianco verdastro o a forma di cristallo.
Peso molecolare
159,61 g/mol
Punto di fusione
A 560 ºC si rompe.
Densità
3,60 g/cm3
Solubilità
22 g/100 g di acqua a 25 ° C. Insolubile in etanolo.
Proprietà chimiche
Quando è sottoposto all'umidità dell'aria inferiore a 30 ° C, diventa il composto cuso pentaidrato4 •5h2O.
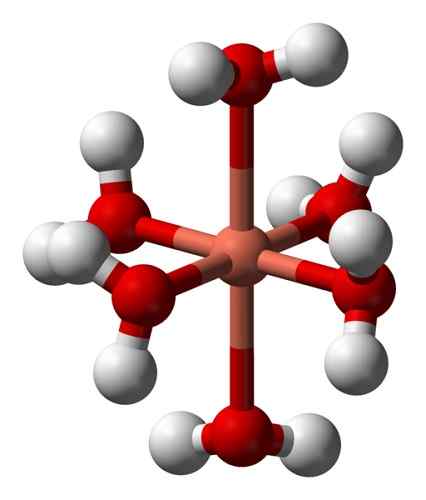
Le sue soluzioni acquose sono blu a causa della formazione dello ione esaeaacuocobre (II) [Cu (H2O)6"2+ che produce tale colorazione. In questo ione due delle molecole d'acqua sono più lontano dall'atomo metallico rispetto alle altre quattro.
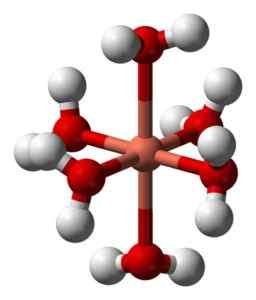 Struttura deformata dello ione esaeaacuocobre (II) [Cu (H2O)6"2+. Benjah-bmm27 / dominio pubblico. Fonte: Wikimedia Commons.
Struttura deformata dello ione esaeaacuocobre (II) [Cu (H2O)6"2+. Benjah-bmm27 / dominio pubblico. Fonte: Wikimedia Commons. Ciò è dovuto al cosiddetto effetto Jahn-Teller, che prevede che questo tipo di sistemi sperimenta la distorsione causata dal fatto che il CU2+ Ha una struttura elettronica che termina in D9, cioè un orbitale incompleto (sarebbe completo se fosse D10).
Può servirti: idrossido di calcio (Ca (OH) 2): struttura, proprietà, ottenimento, usiSe viene aggiunta l'ammoniaca (NH3) Queste soluzioni sono formate in cui l'NH3 Le molecole d'acqua si spostano successivamente. Sono formati ad esempio da [Cu (NH3) (H2O)5"2+ Fino a [Cu (NH3)4(H2O)2"2+.
Quando il cuso4 È riscaldato alla sua decomposizione emette gas tossici e diventa ossido rame.
Ottenimento
Il solfato di rame anidro può essere ottenuto mediante disidratazione totale del composto pentaidrato, che si ottiene riscaldandolo fino a quando le molecole d'acqua evaporano.
Cuso4 •5h2O + calore → CuO4 + 5 h2O ↑
Il composto pentaidrato è blu, quindi l'acqua di Cuso si ottiene quando si perde l'acqua di cristallizzazione4 Anidro bianco.
Applicazioni
Alcuni dei suoi usi si sovrappongono a quello del composto pentaidrato. Altri sono specifici della sostanza anidra.
Come agente antibatterico
Ha un potenziale come agente antimicrobico. È stato usato per migliaia di anni, anche in culture del Sud America e dell'America centrale, per prevenire l'infezione della ferita attraverso una garza impregnata in una soluzione di questo composto.
Si stima che nel meccanismo della sua attività antibatterica gli ioni Cu2+ Formano chelati con enzimi che sono cruciali per le funzioni cellulari dei batteri, disattivandoli. Inducono anche la formazione di radicali idrossilici OH •, che danneggiano le membrane dei batteri e il loro DNA.
 Il cuso4 Può funzionare contro alcuni batteri patogeni. Autore: Gerd Altmann. Fonte: Pixabay.
Il cuso4 Può funzionare contro alcuni batteri patogeni. Autore: Gerd Altmann. Fonte: Pixabay. Recentemente è stato riferito che le tracce di Cuso4 Possono aumentare l'attività antimicrobica di prodotti naturali ricchi di polifenoli, come estratti di granate e infusioni di alcuni tipi di piante da tè.
In applicazioni veterinarie
È usato come antisettico e astringente per le mucose e per trattare la congiuntivite esterna e l'otite. Serve a eseguire bagni terapeutici o profilattici per evitare il marciume di bovini, pecore e altri mammiferi.
 Soluzioni acquose CUO4 Servono a curare i buchi per il bestiame. Autori: Ingrid und Stefan Melichar. Fonte: Pixabay.
Soluzioni acquose CUO4 Servono a curare i buchi per il bestiame. Autori: Ingrid und Stefan Melichar. Fonte: Pixabay. Funge da agente caustico per masse necrotiche alle estremità di bovini, ulcere da stomatite e tessuto granulato di questi. Ha l'uso come fungicida nel trattamento della tintura e delle malattie causate da funghi cutanei.
Viene anche usato come emético (agente per provocare vomito) in maiali, cani e gatti; Come antidiarrota astringente per i vitelli e per controllare la moniliasi intestinale nel pollame e nella tricomoniasi della tacchino.
Come supplemento di alimentazione per animali
Il solfato di rame è stato usato come integratore in quantità molto piccole per alimentare bovini, maiali e pollame. Serve a trattare la carenza di rame nei ruminanti. Nel caso di maiali e uccelli è usato come stimolante della crescita.
Può servirti: cromatogrammaIl rame è stato identificato come essenziale per la biosintesi dell'emoglobina nei mammiferi, la struttura cardiovascolare, la sintesi del collagene osseo, i sistemi enzimatici e la riproduzione.
Come menzionato nella sezione precedente, può anche essere fornito come farmaco per il controllo delle malattie. Tuttavia, i livelli di supplementazione e/o farmaci devono essere monitorati con cura.
 Gli uccelli corrali e le loro uova possono essere influenzati da un eccesso di solfato di rame nella loro dieta. Autore: Pexels. Fonte: Pixabay.
Gli uccelli corrali e le loro uova possono essere influenzati da un eccesso di solfato di rame nella loro dieta. Autore: Pexels. Fonte: Pixabay. Da una certa quantità, che dipende da ciascuna specie, può una diminuzione della crescita, della perdita di appetito e del peso, il danno a determinati organi e persino la morte degli animali può verificarsi.
Ad esempio, nei polli la supplementazione dello 0,2% o più diminuisce l'ingestione di alimenti di questi con la conseguente perdita di peso, la riduzione della produzione di uova e lo spessore delle loro bucce.
In applicazioni agricole
Nei sistemi di produzione organica non è consentito utilizzare i fungicidi sintetici, sono accettati solo prodotti di rame e zolfo, come il rame solfato.
Ad esempio, alcuni funghi che attaccano le piante di mele, come Venturia inaequalis, vengono eliminati con questo composto. Si pensa che forse gli ioni cu2+ Sono in grado di entrare nella spora del fungo, denaturalizzare le proteine e bloccare diversi enzimi.
 Il solfato di rame serve a combattere alcuni funghi che attaccano le mele. Algirdas a Lt.Wikipedia / dominio pubblico. Fonte: Wikimedia Commons.
Il solfato di rame serve a combattere alcuni funghi che attaccano le mele. Algirdas a Lt.Wikipedia / dominio pubblico. Fonte: Wikimedia Commons. Importanza del rame nelle piante
L'elemento di rame è importante nei processi fisiologici di piante come la fotosintesi, la respirazione e la difesa contro gli antiossidanti. Sia la carenza di questo elemento che il suo eccesso generano specie ossigenate reattive che sono dannose per le molecole e le strutture di queste.
L'intervallo delle concentrazioni di rame per una crescita ottimale e lo sviluppo delle piante è molto stretto.
Effetti avversi sull'agricoltura
Quando questo prodotto è eccessivamente utilizzato nelle attività agricole, può essere fitotossico, causare lo sviluppo prematuro della frutta e cambiare il suo colore.
Inoltre, il rame si accumula a terra ed è tossico per i microrganismi e i lombrichi. Ciò confonde sul concetto di agricoltura organica.
 Sebbene il CUSO4 È usato nell'agricoltura biologica può essere dannoso per i vermi della terra. Autore: Patricia Maine DeGrave. Fonte: Pixabay.
Sebbene il CUSO4 È usato nell'agricoltura biologica può essere dannoso per i vermi della terra. Autore: Patricia Maine DeGrave. Fonte: Pixabay. Sulle reazioni chimiche
Il cuso4 Anidro funge da catalizzatore per diverse reazioni di composti organici carbonilici con diolici o loro epossidi, formando diossolani o acetonidi. Grazie a questo composto le reazioni possono essere fatte in condizioni morbide.
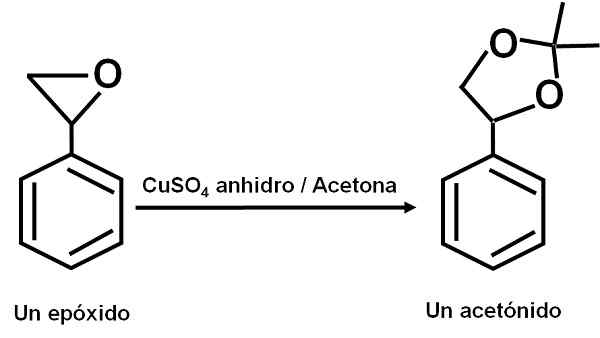 Esempio di reazione in cui il CUSO4 Anidro agisce come catalizzatore. Autore: Marilú Stea.
Esempio di reazione in cui il CUSO4 Anidro agisce come catalizzatore. Autore: Marilú Stea. È stato anche riferito che la sua azione catalitica consente di disidrare alcoli secondari, terziari, benzilici e alilici ai suoi corrispondenti olefine. La reazione è fatta in un modo molto semplice.
Può servirti: anetolL'alcool puro viene riscaldato insieme al CUSO4 anidro a una temperatura di 100-160 ° C per un tempo di 0,5-1,5 ore. Pertanto, si verifica disidratazione di alcol e olefina, distili puri dalla miscela di reazione.
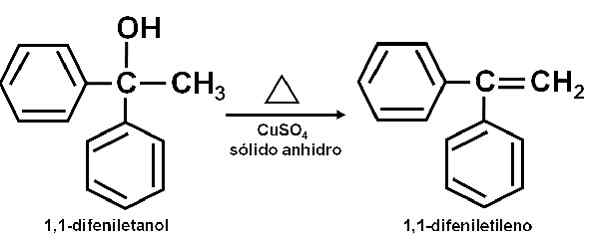 Disidratazione di un alcol per rame solfato (II) anidro. Autore: Marilú Stea.
Disidratazione di un alcol per rame solfato (II) anidro. Autore: Marilú Stea. Come agente disidratante
Questo composto viene utilizzato nei laboratori chimici come essiccante. Serve a disidratare fluidi organici come solventi. Assorbire l'acqua che forma il composto CuO pentaidrato4 •5h2O.
 Quando il cuso4 L'anidro bianco assorbe l'acqua diventa il composto pentaidrato blu4.5h2O. Crystal Titan/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons.
Quando il cuso4 L'anidro bianco assorbe l'acqua diventa il composto pentaidrato blu4.5h2O. Crystal Titan/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons. Per migliorare i polimeri
Il cuso4 Anhydro è stato usato per migliorare le proprietà di alcuni polimeri e allo stesso tempo consentire loro di essere riciclabili.
Ad esempio, le particelle del composto di acetone sono state miscelate con gomma acrilonitrile-butadiene in un mulino speciale, cercando di creare particelle di cuso4 Sii molto piccolo.
Il solfato di rame migliora i punti dell'Unione polimerica formando una miscela con alta resistenza, durezza e flessibilità sorprendente.
In applicazioni terapeutiche interrotte
In passato, sono state utilizzate soluzioni di solfato di rame per il lavaggio gastrico quando qualcuno ha sofferto di avvelenamento da fosforo bianco. Tuttavia, la soluzione si è mossa prontamente per evitare l'avvelenamento da rame.
Le soluzioni di questo composto sono state utilizzate anche insieme ad altre sostanze per ustioni topiche nella pelle dal fosforo.
A volte servivano in determinate forme di nutrizione.
Alcune lozioni per Eczema, Impetigo e Intertrigo contenevano CUO4. Le soluzioni sono state usate come astringente nelle infezioni degli occhi. A volte i cristalli venivano applicati direttamente su ustioni o ulcere.
Tutte queste applicazioni non sono più fatte a causa della tossicità che può indurre un composto in eccesso.
Riferimenti
- O.S. Biblioteca nazionale di medicina. (2019). Solfato di rame. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Piombo, d.R. (Editor) (2003). Manuale CRC di chimica e fisica. 85th CRC Press.
- Montag, J. et al. (2006). Uno studio in vitro su Venturia inaequalis. J. Agr. CHEM alimentare. 2006, 54, 893-899. Link recuperato.Springer.com.
- Holloway, a.C. et al. (2011). Miglioramento delle attività antimicrobiche di tè bianco intero e sotto-frazionato mediante dipendenza da solfato di rame (II) e vitamina C contro Staphylococcus aureus; All'approccio meccanicistico. BMC Complement Altern Altern Med 11, 115 (2011). Estratto da BMCComplementMedEtherapies.biomedcentral.com.
- Sanz, a. et al. (2018). Meccanismo di assorbimento di rame di Thalian Arabidopsis Trasportatori di Copt ad alta città. Protoplasma 256, 161-170 (2019). Link recuperato.Springer.com.
- Griminger, p. (1977). Effetto del solfato di rame sulla produzione di uova e spessore del guscio. Poultry Science 56: 359-351, 1977. Recuperato dall'accademico.Oup.com.
- Hanzlik, r.P. E Leinwetter, m. (1978). Reazione di epossidi e composti carbonilici catalizzati da solfato di rame anidro. J. Org. Chimica., Vol.43, n.3, 1978. Recuperato dai pub.sindrome coronarica acuta.org.
- Okonkwo, a.C. et al. (1979). Requisito di rame dei maiali per bambini alimentati con dieta purificata. The Journal of Nutrition, Volume 109, Numero 6, giugno 1979, pagine 939-948. Recuperato dall'accademico.Oup.com.
- Hoffman, r.V. et al. (1979). Rame anidro (ii) solfato: un efficienza. J. Org. Chimica., 1980, 45, 917-919. Recuperato dai pub.sindrome coronarica acuta.org.
- Shao, c. et al. (2018). Migliora resistenza alla trazione della gomma acrilonitrile-butadiene/compositi di solfato di rame anidro preparato mediante reticolazione coordinamento. Polimero. Toro. 76, 1435-1452 (2019). Link recuperato.Springer.com.
- Betts, j.W. et al. (2018). Nuovi antibatterici: alternative agli antibiotici tradizionali. Rame. In progressi nella fisiologia microbica. Recuperato da ScienceDirect.com
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Siti di Google. Fare solfato di rame anidro. In Paradox Home Chemistry. Recuperato dai siti.Google.com.
- « Caratteristiche della regola T, in modo che serva, esempi
- Concetto costante (programmazione), tipi, esempi »

