Succinato deidrogenasi Struttura, funzione, regolazione, malattie
- 4594
- 635
- Dott. Rodolfo Gatti
SUccinato deidrogenasi (Sdh), noto anche come complesso II della catena di trasporto di elettroni, è un complesso proteico mitocondriale con attività enzimatica che funziona sia nel ciclo di Krebs che nella catena del trasportatore di elettroni (respirazione cellulare).
È un enzima presente in tutte le cellule aerobiche. Negli eucarioti è un complesso strettamente associato alla membrana mitocondriale interna, mentre nei procarioti si trova nella membrana plasmatica.
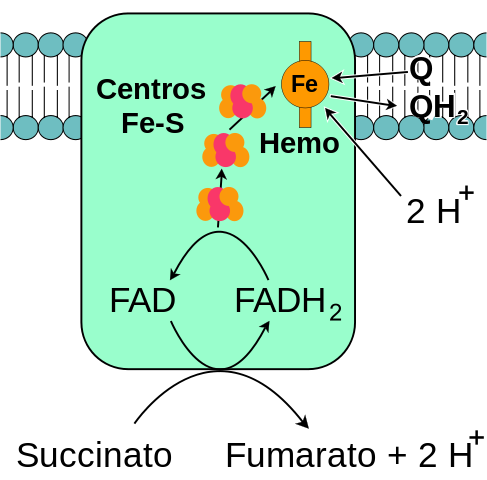 Schema generale del complesso mitocondriale succinato deidrogenasi (fonte: me stesso, basato sulla vettorializzazione di Fvasconcellos. / Dominio pubblico, via Wikimedia Commons)
Schema generale del complesso mitocondriale succinato deidrogenasi (fonte: me stesso, basato sulla vettorializzazione di Fvasconcellos. / Dominio pubblico, via Wikimedia Commons) Il complesso succinato deidrogenasi, scoperto intorno al 1910 e purificato per la prima volta nel 1954 da Singer e Kearney, è stato ampiamente studiato per diversi motivi:
- Funziona sia nel ciclo di Krebs (ciclo di acido citrico o ciclo di acido tricarbossilico) sia nella catena di trasporto degli elettroni (catalizza l'ossidazione del succinato a fumarato)
- La sua attività è regolata da diversi attivatori e inibitori e
- È un complesso associato a: ferro non collegato a un gruppo Hemo, lo zolfo labilo e i dyucleotidi di Flavina adenina (FAD)
È codificato dal genoma nucleare ed è stato dimostrato che le mutazioni nei quattro geni che codificano ciascuna delle sue subunità (A, B, C e D) provocano vari immagini cliniche, cioè possono essere abbastanza negative dal punto di vista dell'integrità fisica degli esseri umani.
[TOC]
Struttura
Il complesso enzimatico succinato deidrogenasi è formato da quattro subunità (eterotarámero) codificate dal genoma nucleare, quindi è l'unico complesso di fosforilazione ossidativa nella catena del trasporto elettronico che non ha alcuna subunità codificata dal genoma mitocondriale.
Inoltre, questo complesso è l'unico che non pompano i protoni attraverso la membrana mitocondriale interna durante la sua azione catalitica.
Secondo studi basati sul complesso enzimatico delle cellule cardiache suine, la complessa succinato deidrogenasi è costituita da:
- UN "Testa" Idrofilo che si estende dalla membrana mitocondriale interna alla matrice mitocondriale e
- UN "linea" Idrofobico che è incorporato nella membrana mitocondriale interna e che ha un piccolo segmento proiettato verso lo spazio intermembrana solubile dei mitocondri
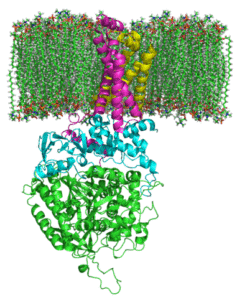 Struttura del complesso succinato deidrogenasi (Fonte: Zephyris at English Language Wikipedia/CC BY-SA (http: // creativeCommons.Org/licenze/by-sa/3.0/) via Wikimedia Commons)
Struttura del complesso succinato deidrogenasi (Fonte: Zephyris at English Language Wikipedia/CC BY-SA (http: // creativeCommons.Org/licenze/by-sa/3.0/) via Wikimedia Commons) Struttura della porzione idrofila
La testa idrofila è composta da SDHA (70 kDa) e SDHB (27 kDa) (SDH1 e SDH2 nei lieviti) e questo comprende il centro catalitico del complesso.
Le subunità SDHA e SDHB contengono cofattori redox che partecipano al trasferimento di elettroni all'ubiquinone (Coenzima Q10, una molecola che trasporta elettroni tra i complessi respiratori I, II e III).
La subunità SDHA ha un cofattore FAD (un coenzima che partecipa alle reazioni di riduzione dell'ossido) insieme alla sua struttura, proprio nel sito di giunzione per il succinato (il substrato principale dell'enzima).
La subunità SDHB ha 3 centri di zucchero di ferro (FE-S) che mediano il trasferimento di elettroni all'Ubiquinone. Uno dei centri, 2Fe-2, è vicino al sito FAD della subunità SDHA e gli altri (4Fe-4s e 3Fe-4s) sono adiacenti al primo.
Può servirti: filogenesiVa notato che gli studi strutturali indicano che la subunità SDHB forma l'interfaccia tra il dominio catalitico idrofilo e il dominio di "ancoraggio" alla membrana (idrofobica) del complesso.
Struttura della porzione idrofobica
Il dominio membrano del complesso, come affermato, è costituito da SDHC (15 kDa) e SDHD (12-13 kDa) (SDH3 e SDH4 nei lievi.
Questo dominio contiene una porzione di Hemo B si unì all'interfaccia tra le subunità SDHC e SDHD, dove ciascuno dei due ligandi di istidina che li tengono uniti.
In questo enzima sono stati rilevati due siti sindacali per Ubiquinona: uno di grande affinità e uno di bassa affinità.
Il sito ad alta affinità, noto come QP (P di prossimale) È faccia a faccia alla matrice mitocondriale ed è formato da specifici residui di aminoacidi situati nelle subunità SDHB, SDHC e SDHD.
Il sito a bassa affinità, chiamato anche QD (D di distale) È, nella parte della membrana mitocondriale interna in cui viene inserito il complesso, più vicino allo spazio intermembrana, cioè più lontano dalla matrice di organelle.
Insieme, il complesso totale ha un peso molecolare vicino a 200 kDa ed è stato stabilito che ha un rapporto di 4.2-5.0 Nanomoli di flavin per milligrammo di proteina e 2-4 g di ferro per ogni mole di Flavina.
Funzione
Il complesso succinato enzimatico deidrogenasi svolge un'importante funzione nei mitocondri, poiché non solo partecipa al ciclo di Krebs (dove partecipa alla degradazione di acetil -CoA), ma anche parte della catena respiratoria, fondamentale per la produzione di energia ATP.
In altre parole, è un enzima chiave per il metabolismo intermedia e la produzione aerobica ATP.
- È responsabile dell'ossidazione del succinato per fumarare nel ciclo dell'acido citrico
- Nutri il complesso III del trasportatore di elettroni con gli elettroni derivati dall'ossidazione del succinato, che aiuta a ridurre l'ossigeno e formare acqua
- Il trasporto elettronico genera un gradiente elettrochimico attraverso la membrana mitocondriale interna, che favorisce la sintesi di ATP
In alternativa, gli elettroni possono essere utilizzati per ridurre le molecole da un "pool" di Ubiquinonas, producendo i riduttori necessari per ridurre gli anioni di superossido che provengono dalla stessa catena respiratoria o provengono da fonti esogene.
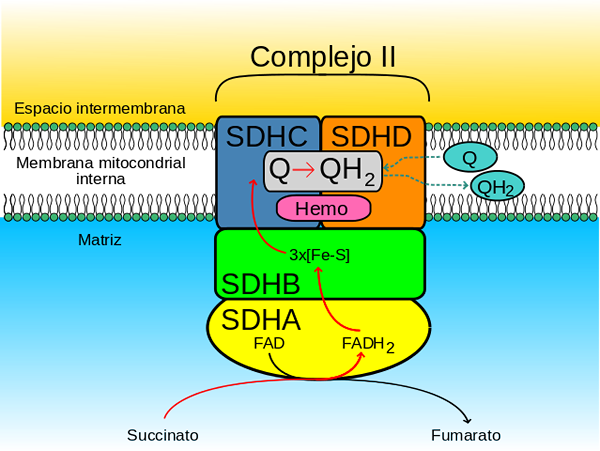 Succinare Degidrogenasa complesso (fonte: Johnhfst / Public Domain, via Wikimedia Commons)
Succinare Degidrogenasa complesso (fonte: Johnhfst / Public Domain, via Wikimedia Commons) Come agisce?
La subunità A del complesso (che è covalentemente legato al coenzima FAD) si unisce ai substrati, fumarati e succinati, nonché i suoi regolatori fisiologici, oxalacetato (inibitore competitivo) e ATP.
L'ATP sposta l'unione tra ossalacetato e complesso SDH e, quindi, gli elettroni che sono "passati" dal succinato alla subunità SDHA vengono trasferiti ai gruppi di atomi di ferro e zolfo presenti nella subunità SDHB per mezzo della FAD di Coenzyme.
Può servirti: miosina: caratteristiche, struttura, tipi e funzioneDalla subunità B, questi elettroni raggiungono i siti di Hemo B Delle subunità SDHC e SDHD, da dove vengono "consegnate" ai coenzimi di Quinonas attraverso i loro siti sindacali a Quinona.
Il flusso elettronico dal succinato attraverso questi trasportatori e persino l'accettore finale, che è ossigeno, è accoppiato alla sintesi di 1.5 molecole ATP per ciascuna coppia elettronica attraverso la fosforilazione della catena respiratoria.
Difetti di Inzima
È stato riferito che le mutazioni nel gene che codifica per la subunità A del complesso succinato deidrogenasi possono causare encefalopatie durante l'infanzia, nel frattempo le mutazioni nei geni che codificano le subunità B, C e D sono state associate alla formazione dei tumori.
Regolamento
L'attività del complesso succinato deidrogenasi può essere regolata da modifiche post -traduzionali come fosforilazione e il acetilazione, Sebbene possa verificarsi anche inibizione del sito attivo.
L'acetilazione di alcuni rifiuti di lisina può ridurre l'attività di questo enzima e questo processo viene effettuato da un enzima di acetilasi noto come SIRT3; La fosforilazione ha lo stesso effetto sull'enzima.
Oltre a queste modifiche, il complesso SDH è anche regolato dagli intermediari del ciclo di Krebs, in particolare il Ossalacetato e il succinare. Oxalacetato è un potente inibitore, mentre il succinato favorisce la dissociazione dell'ossolacetato, che funziona come attivatore.
Impulcinato carenza deidrogenasi
La carenza di succinato deidrogenasi è un'anomalia o un disturbo della catena respiratoria mitocondriale. Questa carenza è causata da mutazioni SDHA (o SDHAF1), SDHB, SDHC e SDHD.
Diverse indagini hanno dimostrato mutazioni omozigote ed eterozigoti in questi geni, in particolare SDHA. Le mutazioni di questi geni causano sostituzioni di aminoacidi nella proteina (in una qualsiasi delle SDHA, B, C o D) o in mancanza che codificano proteine anormalmente brevi.
Pertanto, le sostituzioni degli aminoacidi e la codifica proteica anormalmente corta, danno origine a disturbi o alterazioni dell'enzima SDH, che causano un fallimento nella capacità ottimale dei mitocondri di produrre energia. Questo è ciò che gli scienziati chiamano disturbo della catena respiratoria mitocondriale.
Questo disturbo può essere espresso nell'essere umano fenotipicamente in molti modi. I più noti sono: carenza o mancanza di sviluppo linguistico, quadruplex spastico, contrazioni involontarie muscolari (distonia), debolezza muscolare e miocardiopatia, tra gli altri problemi correlati.
Alcuni pazienti con carenza succinata deidrogenasi possono manifestare la malattia di Leight o la sindrome da Kearns-Saire.
Come viene rilevata la carenza di succinato disidrogenato?
Alcuni studi suggeriscono l'uso di test e analisi qualitativi, nonché analisi biochimica quantitativa, enzimatica, a catena respiratoria. Altri, d'altra parte, suggeriscono la completa espansione da parte della reazione a catena della polimerasi (PCR) degli esoni delle subunità in studio e quindi, il rispettivo sequenziamento.
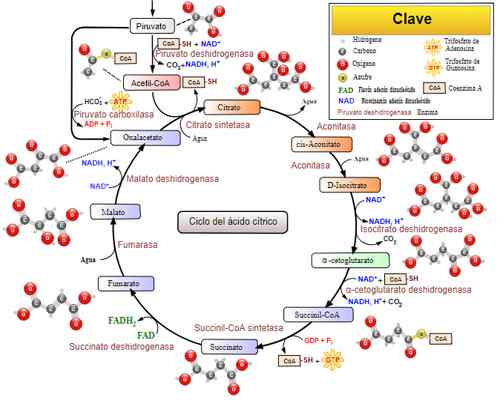 Ciclo di acido tricarbossilico (ciclo Krebs). Preso e curato da: Narayanese, Wikiuerpedia, Yassinemrabet, Totobaggins (tradotto in spagnolo da Alejandro Porto) [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)].
Ciclo di acido tricarbossilico (ciclo Krebs). Preso e curato da: Narayanese, Wikiuerpedia, Yassinemrabet, Totobaggins (tradotto in spagnolo da Alejandro Porto) [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Malattie correlate
Esistono molte espressioni fenotipiche prodotte dai disturbi della catena respiratoria mitocondriale, a causa della carenza di succinato deidrogenasi. Tuttavia, quando si tratta di sindromi o malattie, si parla di quanto segue.
Può servirti: i 8 cicli biogeochimici più importanti (descrizione)Sindrome di Leight
È una malattia neurologica progressiva, associata a mutazioni nel genoma nucleare (in questo caso di deidrogenasi succinata), che colpiscono il complesso piruvato-disishigrogenasi nella via della fosforilazione ossidativa.
I sintomi compaiono prima del primo anno dell'individuo, ma nei casi atipici, sono stati osservati i primi sintomi durante l'adolescenza.
Tra i sintomi più comunemente osservati ci sono: ipotonia con perdita di controllo cefalico, movimenti involontari, vomito ricorrente, problemi respiratori, incapacità di spostare i globuli oculari, la piramide e i segni extrapiramidali, tra gli altri. Le convulsioni non sono molto comuni.
È possibile che la malattia possa essere rilevata nelle diagnosi prenatali. Non è nota una cura o un trattamento specifico, ma alcuni specialisti suggeriscono trattamenti con determinati vitamina o cofattori.
Tumore allo stroma gastrointestinale (GIST)
Comunemente chiamato GIST, è un tipo di tumore del tratto gastrointestinale, che generalmente si sviluppa in aree come lo stomaco o l'intestino tenue. Si ritiene che la causa di questi sia dovuta a un certo gruppo di cellule altamente specializzate chiamate cellule ICC o cellule interstiziali di Cajal.
Altre considerazioni sulla causa di GIST sono le mutazioni di alcuni tipi di geni, che secondo alcuni autori causano il 90% dei tumori. I geni coinvolti sono: kit, geni pdgfra, deidrogenasi succinato (SDH) - scarso.
La succinato deidrogenasi (SDH) - scarsa, si verifica principalmente nelle giovani donne, produce tumori di stomaco e con frequenza relativa produce metastasi nei linfonodi. Una piccola percentuale si verifica nei bambini e nella maggior parte dei casi, è dovuta alla mancanza di espressione della subunità SDHB.
Sindrome di Kearns-Sayre
È stato determinato che alcuni pazienti con carenze succinate deidrogenasi possono manifestare la sindrome di Kearns-Sayre. Questa malattia è correlata ai disturbi mitocondriali ed è caratterizzata dall'assenza di movimento di palloncini oculari.
Altre caratteristiche di questa malattia sono la retinite pigmentaria, la sordità, la cardiomiopatia e le condizioni del sistema nervoso centrale. Di solito questi sintomi si osservano prima che il paziente compia 20 anni. Non è nota alcuna diagnosi prenatale per questa condizione.
Né è cura per questa malattia. Il trattamento è palliativo, cioè funziona solo per ridurre gli effetti della malattia, non la cura. D'altra parte, sebbene dipenda dal numero di organi interessati e dalle cure mediche ricevute, l'aspettativa di vita è relativamente normale.
Riferimenti
- Ackrell, b. A., Kearney, e. B., & Singer, t. P. (1978). [47] mammifero succinato deidrogenasi. In Metodi in enzimologia (vol. 53, pp. 466-483). Academic Press.
- Brère, j. J., Favier, J., Ghouzzi, v. E., Djoudi, f., Benit, p., Gimenez, a. P., & Rustin, P. (2005). Succinare la carenza di deidrogenasi nell'uomo. Scienze della vita cellulare e molecolare CMLS, 62 (19-20), 2317-2324.
- Cecchini, g., Schröder, i., Gunlus, r. P., & Maklashina, e. (2002). Succinare deidrogenasi e fumerare redattasi da Escherichia coli. Biochimica et Biophysica Acta (BBA) -Bioenergetics, 1553 (1-2), 140-157.
- Odiofi, e., & Davis, K. A. (1971). Succinato deidrogenasi. Yo. Purificazione, proprietà molecolari e sottostruttura. Biochimica, 10 (13), 2509-2516.
- Hederstedt, l. A. R. S., & Rutberg, L. A. R. S. (1981). Revisione comparativa del succinato deidrogenasi-A. Recensioni microbiologiche, 45 (4), 542.
- Nelson, d. L., Lechinger, a. L., & Cox, m. M. (2008). Principi di biochimica Lechinger. Macmillan.
- Rutter, j., Winge, d. R., & Schiffman, J. D. (2010). Succinato deidrogenasi-marcia, regolazione e ruolo nella diew umana. Mithocondrion, 10 (4), 393-401.
- « Funzioni di acidi grassi essenziali, importanza, nomenclatura, esempi
- Caratteristiche della regola T, in modo che serva, esempi »

