Componenti della soluzione ipotonica, preparazione, esempi
- 4953
- 1138
- Lidia Valentini
UN Soluzione ipotonica È quello che presenta una concentrazione di soluto minore rispetto a una soluzione separata o isolata da un bug semipermeabile. Questa barriera consente al solvente di trans, acqua in caso di sistemi biologici, ma non tutte particelle di soluto.
I fluidi corporei di vertebrati intracellulari ed extracellulari hanno un'osmolarità di circa 300 mOSm/L. Mentre si considera che un liquido ipotonico abbia un'osmolarità inferiore a 280 MOSM/L. Quindi una soluzione di questa osmolarità è ipotonica in relazione al mezzo cellulare.
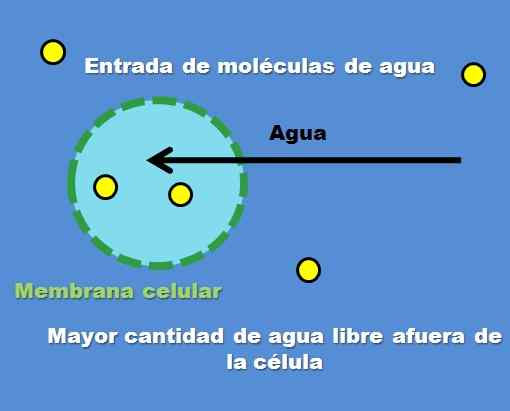
 Interazione di una cellula con una soluzione ipotonica. Fonte: Gabriel Bolívar.
Interazione di una cellula con una soluzione ipotonica. Fonte: Gabriel Bolívar. Un esempio di soluzione ipotonica è lo 0,45% di cloruro di sodio. Ma come si comportano la cella o il compartimento di fronte a questo tipo di soluzione? L'immagine superiore risponde a questa domanda.
La concentrazione di particelle di soluto (punti gialli) è più alta all'interno della cellula esterna. Avendo meno soluto intorno alla cellula, ci sono più molecole d'acqua libere, quindi è rappresentato con un colore blu più intenso rispetto all'interno della cellula.
L'acqua scorre verso l'esterno attraverso l'osmosi a concentrazioni di livello. Di conseguenza, la cellula si espande o si espande assorbendo l'acqua che attraversa la sua membrana cellulare.
[TOC]
Componenti di soluzioni ipotoniche
Le soluzioni ipotoniche consistono in un solvente che, se non diversamente indicato, consiste in acqua e soluti disciolti come sali, zuccheri, ecc., in forma pura o mista. Ma questa soluzione non avrà alcuna tonicità se non esiste una barriera semipermeabile, che diventa la membrana cellulare.
Può servirti: nitrato di calcio (Ca (NO3) 2)Ci devono essere pochi sali disciolti in modo che la sua concentrazione sia piccola, mentre la "concentrazione" dell'acqua è alta. Avere più acqua libera al di fuori della cella, cioè non sta risolvendo o idratare particelle di soluto, maggiore è la sua pressione sulla membrana cellulare e più tende a attraversarla per diluire il fluido intracellulare.
Preparazione di una soluzione ipotonica
Per la preparazione di queste soluzioni, lo stesso protocollo viene seguito come seguito per altre soluzioni. Vengono effettuati i calcoli appropriati della massa dei soluti. Quindi questi vengono pesati, dissolversi in acqua e prendere una bandiera condivisa al volume che corrisponde ad esso.
La soluzione ipotonica ha una bassa osmolarità, di solito inferiore a 280 mOSM/L. Quindi, quando preparano una soluzione ipotonica, dobbiamo calcolare l'osmolarità in modo tale che il suo valore sia inferiore a 280 MOSM/L. L'osmolarità può essere calcolata con la seguente equazione:
Osmolarità = m · v · g
Dove M È la molarità del soluto e v Il numero di particelle in cui un composto è dissociata in soluzione. Le sostanze non elettrolitiche non si dissociano, quindi il valore di V è uguale a 1. Questo è il caso del glucosio e di altri zuccheri.
Mentre G è il coefficiente osmotico. Questo è un fattore di correzione per l'interazione di particelle (ioni) caricate elettricamente in soluzione. Per soluzioni diluite e sostanze non dissociate, ad esempio e di nuovo glucosio, viene preso un valore di G uguale a 1. Si dice quindi che la molarità è identica alla sua osmolarità.
Esempio 1
Preparare una soluzione di cloruro di sodio (NaCl) allo 0,5 % (P/V) controllando se si tratta o meno di una soluzione ipotonica. Peso molecolare NaCl = 58,5 g/mol.
Viene trasportato lo 0,5 % di una soluzione di NaCl Gram per litro:
Può servirti: perossido di calcio (CaO2): proprietà, rischi e usiNaCl in g/l = (0,5 g ÷ 100 ml) · 1.000 ml
= 5 g/l
E procediamo a calcolare la sua molarità e quindi determiniamo la sua osmolarità:
Molarità = massa (g/l) ÷ peso molecolare (g/mol)
= 5 g/l ÷ 58,5 g/mol
= 0,085 moli/L
NaCl si dissocia in due particelle: Na+ (cation) e cl- (anione). Quindi il valore di v = 2. Inoltre, poiché è una soluzione di NaCl diluita allo 0,5 %, si può presumere che il valore di G (coefficiente osmotico) sia 1. Allora abbiamo:
Osmolarità (NaCl) = molarità · v · g
= 0,085 m · 2 · 1
= 0,170 OSM/L O 170 MOSM/L
Questa è una soluzione ipotonica, poiché la sua osmolarità è molto inferiore all'osmolarità di riferimento per i fluidi corporei che è osmolarità plasma.
Esempio 2
Preparare una soluzione di una miscela di cloruro di calcio (CACL2) a 0,055 % (P/V) e glucosio (C6H12O6) al 4 % (p/v). Pesi molecolari: CACL2 = 111 g/mol e c6H12O6 = 180 g/mol.
Calcoliamo la molarità con le concentrazioni dei rispettivi soluti a 0,55 g/L e 40 g/L:
Molarità (CACL2) = 0,55 g/L ÷ 111 g/mol
= 4.95 · 10-3 M
= 4,95 mm
Molarità (c6H12O6) = 40 g/l ÷ 180 g/mol
= 0,222 m
= 222 mm
E allo stesso modo calcoliamo le osmolarità, sapendo che il clic2 Si dissocia su tre ioni, due CL- E un ca2+, e supponendo che siano soluzioni molto diluite, quindi il valore di v È 1. Abbiamo:
Osmolarità (CACL2) = 4,95 mm · 3 · 1
= 14,85 MOSM/L
Osmolarità di (c6H12O6) = 222 mm · 1 · 1
= 222 MOSM/L
Infine, l'osmolarità totale della soluzione diventa la somma delle singole osmolarità; cioè da quelli di NaCl e glucosio. Questo è quindi:
Può servirti: materiali refrattariOsmolarità totale della soluzione = Osmolarità Cacl2 + osmolarità c6H12O6
= 222 MOSM/L + 14,85 MOSM/L
= 236,85 MOSM/L
La soluzione della miscela di calcio e cloruro di glucosio è ipotonica, poiché la sua osmolarità (236,85 mosm/L) è molto inferiore all'osmolarità plasmatica (300 mosm/L), che viene presa come riferimento come riferimento.
Esempi di soluzioni ipotoniche
Soluzione di cloruro di sodio
La soluzione di cloruro di sodio 0,45 % viene somministrata per via per via endovenosa a pazienti con chetosi diabetica che sviluppano disidratazione in compartimenti interstiziali e intracellulari. L'acqua scorre dal plasma a quegli scomparti.
Soluzione lattata suoneria
Soluzione il lattata Ringer n. 19 è un altro esempio di soluzione ipotonica. La sua composizione è 0,6 g di cloruro di sodio, 0,03 g di cloruro di potassio, 0,02 g di cloruro di calcio, 0,31 g di lattato di sodio e 100 ml di acqua distillata. È una soluzione utilizzata per la reidratazione del paziente ed è leggermente ipotonica (274 MOSM/L).
Riferimenti
- Da Lehr Spilva, a. E muktans, e. (1999). Guida alle specialità farmaceutiche in Venezuela. Edizione XXXVª. Edizioni globali.
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Wikipedia. (2020). Tonicità. Recuperato da: in.Wikipedia.org
- Union Media LLC. (2020). Soluzioni isotoniche, ipotoniche e ipertoniche. Estratto da: UnionTestPrep.com
- Lodish H, Berk A, Zipursky SL, et al. (2000). Sezione 15.8osmosi, canali d'acqua e regolazione del volume cellulare. Libreria NCBI. Recuperato da: NCBI.Nlm.NIH.Gov
- John Brennan. (13 marzo 2018). Come calcolare l'isotonicità. Recuperato da: scientifici.com
- « Matilde Hidalgo de Prince Biografia, Contributi e Works
- Le 15 caratteristiche teatrali più importanti »

