Storia, proprietà, struttura, ottenimento del silicio

- 1481
- 321
- Kayla Serr
Lui silicio È un elemento non metallico e allo stesso tempo metalloide rappresentato dal simbolo chimico se. È un semiconduttore, che è una parte essenziale di computer, calcolatori, telefoni cellulari, celle solari, diodi, ecc.; È praticamente la componente principale che ha permesso l'insediamento dell'era digitale.
Il silicio è sempre stato presente in quarzo e silicati, entrambi i minerali che compongono circa il 28% in massa di tutta la crosta terrestre. È quindi il secondo elemento più abbondante sulla superficie della terra e la vastità dei deserti e delle spiagge offre una prospettiva di quanto sia abbondante.
 I deserti sono un'abbondante fonte naturale di particelle di silice o graniti con altri minerali. Fonte: pxhere.
I deserti sono un'abbondante fonte naturale di particelle di silice o graniti con altri minerali. Fonte: pxhere. Il silicio appartiene al gruppo 14 della tavola periodica, lo stesso del carbonio, situato al di sotto di questo. Ecco perché questo elemento è considerato una metalloide tetravalente; Ha quattro elettroni di Valencia e in teoria puoi perderli tutti per formare il catione se4+.
Una proprietà che condivide con carbone è la sua capacità di concatenare; Cioè, i loro atomi sono collegati in modo covalente per definire le catene molecolari. Allo stesso modo, il silicio può formare i propri "idrocarburi", chiamati Siltans.
I composti predominanti di silicio in natura sono i famosi silicati. Nella sua forma pura può verificarsi come un solido monocristallino, poliristalina o amorfo. È un solido relativamente inerte, quindi non rappresenta rischi considerevoli.
[TOC]
Storia
La pietra del silicio
Il silicio è forse uno degli elementi che ha avuto la maggiore influenza sulla storia dell'umanità.
Questo elemento è il protagonista dell'età della pietra e anche dell'era digitale. Le loro origini risalgono quando le civiltà lavoravano con il quarzo e facevano il proprio bicchiere; E attualmente è il componente principale di computer, laptop e smartphone.
Praticamente il silicio è stata la pietra di due epoche chiaramente definite nella nostra storia.
Isolamento
Quando la silice era così abbondante, un nome nato dalla roccia Flint, doveva contenere un elemento estremamente ricco nella crosta terrestre; Questo fu il successo del sospetto di Antoine Lavoisier, che nel 1787 fallì nei suoi tentativi di ridurlo dal suo ossido.
Qualche tempo dopo, nel 1808 Humphry Davy fece i suoi tentativi e assegnò il suo nome all'elemento: "silicium", che tradotto sarebbe stato come "metallo pedonale". Cioè, il silicio da allora era considerato un metallo a causa della sua mancanza di caratterizzazione.
Poi, nel 1811 i chimici francesi Joseph L. Gay-Lussac e Louis Jacques Thénard sono riusciti a preparare per la prima volta il silicio amorfo. Per questo hanno reagito il tetrafluoride di silicio con potassio metallico. Tuttavia, non hanno purificato o caratterizzato il prodotto ottenuto, quindi non hanno concluso che era il nuovo elemento di silicium.
Non era altro che nel 1823 quando il chimico svedese Jacob Berzelius ottenne un silicio amorfo con una purezza sufficiente per riconoscerlo come silicio; Nome dato nel 1817 dal chimico scozzese Thomas Thomson quando lo considera un elemento non metallico. Berzelius ha effettuato la reazione tra potassio e fluorosilicato di potassio fuso per produrre questo silicio.
Silicio cristallino
Il silicio cristallino fu preparato per la prima volta nel 1854 dal chimico francese Henry Deville. Per raggiungere questo obiettivo, Deville ha realizzato un'elettrolisi di una miscela di cloruri di alluminio e sodio, ottenendo così cristalli di silicio coperto da uno strato di siliciuro di alluminio, che ha eliminato (apparentemente) lavandoli con acqua con acqua.
Proprietà fisiche e chimiche
Aspetto fisico
 Silicio elementare, che ha una lucentezza metallica, ma in realtà è una metalloide. Fonte: immagini ad alta risoluzione di elementi chimici [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)]
Silicio elementare, che ha una lucentezza metallica, ma in realtà è una metalloide. Fonte: immagini ad alta risoluzione di elementi chimici [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)] Il silicio nella sua forma pura o elementare è costituito da un'immagine bluastra grigiastra o nera (immagine superiore), che sebbene non sia un metallo, presenta facce luminose come se lo fosse davvero.
È un solido duro ma fragile, che mostra anche una superficie squamosa se forma da poliristales. D'altra parte, il silicio amorfo sembra un solido in polvere marrone scuro. Grazie a questo, è facile identificare e differenziare un tipo di silicio (cristallino o poliristalina) da un altro (amorfo).
Massa molare
28.085 g/mol
Numero atomico (Z)
14 (14Sì)
Punto di fusione
1414 ºC
Punto di ebollizione
3265 ºC
Densità
-A temperatura ambiente: 2,33 g/ml
-Proprio al punto di fusione: 2,57 g/ml
Si noti che il silicio liquido è più denso del silicio solido; Ciò significa che i loro cristalli galleggono su una fase liquida, come con il sistema di acqua ghiacciata. La spiegazione è dovuta al fatto che lo spazio interatomico tra gli atomi se nel suo vetro è maggiore (meno denso), rispetto al corrispondente nel liquido (denso).
Calore di fusione
50,21 kJ/mol
Calore di vaporizzazione
383 kJ/mol
Capacità termica molare
19.789 J/(mol · K)
Elettronegatività
1,90 sulla scala Pauling
Energie di ionizzazione
-Primo: 786,5 kJ/mol
-Secondo: 1577.1 KJ/mol
-Terzo: 3231,6 kJ/mol
Radio atomica
111 pm (misurato nei rispettivi cristalli di diamanti)
Conduttività termica
149 W/(M · K)
Resistività elettrica
2.3 · 103 Ω · m a 20 ºC
Durezza MOHS
6.5
Concatenazione
Gli atomi di silicio hanno la capacità di formare semplici collegamenti Si-Si, che finiscono per definire una catena (Si-Si-Si ...).
Questa proprietà si manifesta anche per carbonio e zolfo; Tuttavia, ibridazioni SP3 del silicio sono più carenti rispetto a quello degli altri due elementi e, inoltre, i loro orbitali 3p sono più diffusi, quindi la sovrapposizione degli orbitali SP3 risultante è più debole.
Può servirti: reazioni esotermiche ed endotermicheLe energie medie dei legami covalenti SI-SI e C-C sono rispettivamente 226 kJ/mol e 356 kJ/mol,. Pertanto, i collegamenti si-if sono più deboli. Per questo motivo, il silicio non è la pietra angolare della vita (né lo zolfo). In effetti, la catena o lo scheletro più lungo che il silicio può formare è di solito quattro membri (se4).
Numeri di ossidazione
Il silicio può avere uno dei seguenti numeri di ossidazione, supponendo in ciascuno di essi l'esistenza degli ioni con i loro rispettivi carichi: -4 (sì4-), -3 (sì3-), -2 (sì2-), -1 (sì-), +1 (sì+), +2 (sì2+), +3 (sì3+) e +4 (sì4+). Di tutti loro, i -4 e +4 sono i più importanti.
Ad esempio, -4 è assunto in siliciuros (MG2Sì o mg22+Sì4-); mentre +4 corrisponde a quello della silice (SIO2 o se4+O22-).
Reattività
Il silicio è completamente insolubile in acqua, così come acidi o basi forti. Tuttavia, si dissolve in una miscela concentrata di acidi nitrici e fluorhorici (HNO3-HF). Allo stesso modo, si dissolve in una soluzione alcalina calda, si verifica la seguente reazione chimica:
Sì (s) + 2Naoh (AC) + H2O (l) => na2Sio3(AC) + 2H2(G)
Il metasilicato di sodio, Na2Sio3, Si forma anche quando il silicio si dissolve nel carbonato di sodio fuso:
Sì (s) + Na2Co3(L) => na2Sio3(L) + C (S)
A temperatura ambiente non reagisce affatto con l'ossigeno, nemmeno a 900 ° C, quando uno strato vitreo protettivo SIIO inizia a formarsi2; E poi, a 1400 ° C, il silicio reagisce con l'azoto d'aria per formare una miscela di nitrure, senza e se3N4.
Il silicio reagisce anche ad alte temperature con metalli per formare siliciuros metallici:
2mg (s) + sì (s) => mg2Si)
2Cu (s) + sì (s) => cu2Si)
A temperatura ambiente, reagisce esplosivo e direttamente con alogeni (non esiste un livello SIO2 che lo protegge da questo). Ad esempio, hai la reazione di formazione SIF4:
Sì (s) + 2f2(g) => sif4(G)
E sebbene il silicio sia insolubile nell'acqua, Red Alive reagisce con una corrente di vapore:
Sì (s) + H2O (g) => si2(s) + 2h2(G)
Struttura elettronica e configurazione
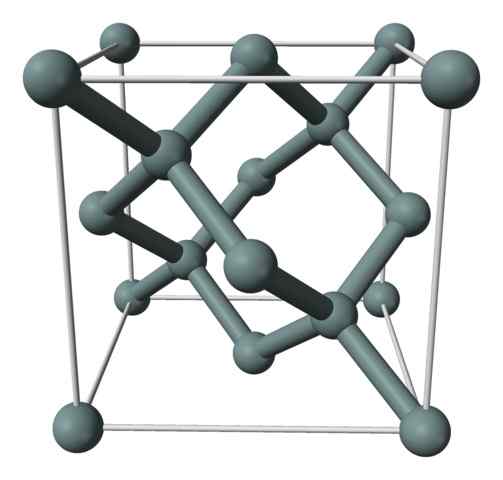 Struttura cristallina o la cellula unitaria del silicio rappresentato con un modello di sfere e barre. Fonte: Benjah-BMM27 [dominio pubblico]
Struttura cristallina o la cellula unitaria del silicio rappresentato con un modello di sfere e barre. Fonte: Benjah-BMM27 [dominio pubblico] L'immagine superiore mostra la struttura cubica centrata sui volti (FCC), la stessa di quella del diamante, per il cristallo di silicio. Le sfere grigie corrispondono agli atomi se, come apprezzati, sono collegate in modo covalente tra loro; Inoltre, hanno ambienti tetraedrici che si riproducono lungo il vetro.
Il cristallo di silicio è FCC perché si osserva un atomo se situato su ciascuna delle facce del cubo (6 × 1/2). Ci sono anche otto atomi se nei vertici del cubo (8 × 1/8) e quattro situati al suo interno (quelli che mostrano un tetraedro ben definito intorno a loro, 4 × 1).
Detto quanto sopra, ogni cella unitaria ha un totale di otto atomi di silicio (3 + 1 + 4, numeri indicati nel paragrafo sopra); Caratteristica che aiuta a spiegare la sua alta durezza e rigidità, perché il silicio puro è un cristallo covalente e un diamante.
Carattere covalente
Questo carattere covalente è dovuto al fatto che, come il carbonio, il silicio ha quattro elettroni di valenza secondo la sua configurazione elettronica:
[Ne] 3s2 3p2
Per collegare, gli orbitali puri 3s e 2p sono inutili. Ecco perché l'atomo crea quattro orbitali ibridi SP3, Con cui è possibile formare quattro legami covalenti Si-Si e, in questo modo, completa l'ottetto di Valencia per i due atomi di silicio.
Il cristallo di silicio viene quindi visualizzato come una rete covalente e tridimensionale composta da tetraedri interconnessi.
Tuttavia, questa rete non è perfetta, poiché presenta difetti e limiti di grano, che separano e definiscono un cristallo da un altro; E quando tali cristalli sono molto piccoli e numerosi, si parla di un solido poliristalina, identificato dalla sua luminosità eterogenea (simile a un mosaico truffato o argento superficiale).
Conducibilità elettrica
I collegamenti Si-if, con i loro elettroni ben posizionati, in linea di principio non sono d'accordo con ciò che ci si aspetta da un metallo: un mare di elettroni che "bagnano" i loro atomi; Almeno, questo è così a temperatura ambiente.
Quando la temperatura aumenta, tuttavia, il silicio inizia a guidare l'elettricità e, quindi, si comporta come un metallo; Cioè, è un elemento metalloide a semiconduttore.
Silicio amorfo
I tetraHeders di silicio non adottano sempre un modello strutturale, ma possono essere disposti in modo disordinato; E anche, con atomi di silicio le cui ibridazioni sembrano essere SP3 Ma sp2, che contribuisce ad aumentare ulteriormente il grado di disturbo. Pertanto, si parla di un silicio amorfo e non cristallino.
Nel silicio amorfo ci sono posti vacanti elettronici, in cui alcuni dei loro atomi hanno un orbitale con un elettrone scomparso. Grazie a ciò, il suo solido può idrogeno stesso, dando origine alla formazione di silicio amorfo idrogeno; Cioè, ha collegamenti Si-H, con i quali i tetraedri sono completati in posizioni disordinate e arbitrarie.
Può servirti: collegamenti interatomiciQuesta sezione si conclude quindi affermando che il silicio può essere presentato in tre tipi di solidi (per non parlare del suo grado di purezza): cristallina, poliristalina e amorfa.
Ognuno di essi ha il suo metodo o il suo processo di produzione, nonché le sue applicazioni e il dilemma quando decide quale dei tre utilizzare, conoscendo i loro vantaggi e svantaggi.
Dov'è e ottieni
 I cristalli di quarzo (silice) sono uno dei minerali principali e più straordinari in cui si trova il silicio. Fonte: James St. John (https: // www.Flickr.com/foto/jsjgeology/22437758830)
I cristalli di quarzo (silice) sono uno dei minerali principali e più straordinari in cui si trova il silicio. Fonte: James St. John (https: // www.Flickr.com/foto/jsjgeology/22437758830) Il silicio è il settimo elemento più abbondante dell'universo, e il secondo nella crosta terrestre, arricchendo anche il mantello della terra con la sua vasta famiglia di minerali. Questo elemento è associato straordinariamente bene all'ossigeno, formando una vasta gamma di ossidi; Tra questi, silice, così2, e silicati (composizione chimica diversa).
La silice può essere vista ad occhio nudo nei deserti e nelle spiagge, perché la sabbia è principalmente composta da SIO2. A sua volta, questo ossido può manifestarsi in alcuni polimorfi, essendo il più comune: quarzo, ametista, agata, christobalite, tripoli, coesite, stishovita e thundimita. Inoltre, può essere trovato in solidi amorfi come opali e terre di diatomea.
I silicati, nel frattempo, sono persino più ricchi strutturalmente e chimicamente. Tra alcuni dei minerali di silicati possono essere menzionati: amianto (bianco, caffè e bluastro), feldspato, argille, micci, olive, alluminosilati, zeoliti, anfibi e pirosseni.
Praticamente, tutte le rocce sono composte da silicio e ossigeno, con i loro legami stabili SI-O e i loro silicati e silicati mescolati con ossidi metallici e specie inorganiche.
-Riduzione della silice
Il problema che rappresenta l'ottenimento di silicio è rompere questo link SI-O, per il quale sono necessari forni speciali e una buona strategia di riduzione. La materia prima per questo processo è silice a forma di quarzo, che si muove in precedenza fino a quando non è una polvere fine.
Da questa silice a terra, può essere preparato dal silicio amorfo o dalla poliristalina.
Silicio amorfo
Su piccola scala, realizzato in un laboratorio e con le misure pertinenti, la silice viene miscelata con polvere di magnesio in un melting pot ed è incenerita in assenza di aria. La prossima reazione si svolge quindi:
Sio2(s) + mg (s) => 2mgo (s) + sì (s)
Il magnesio e l'ossido vengono eliminati con una soluzione di acido cloridrico diluito. Quindi, il solido rimanente viene trattato con acido fluorhorico, in modo che finisca reagendo il SIO2 in eccesso; Altrimenti, l'eccesso di magnesio favorisce la formazione del suo rispettivo siliciuro, MG2Sì, composto indesiderabile per il processo.
Il Sio2 Si trasforma in gas volatile SIF4, che viene recuperato per altre sintesi chimiche. Infine, l'impasto di silicio amorfo viene essiccato sotto una corrente di idrogeno a gas.
Un altro metodo simile per ottenere silicio amorfo è usare lo stesso SF4 precedentemente prodotto o SICL4 (precedentemente acquisito). I vapori di questi alogenuri di silicio vengono passati su sodio liquido in un'atmosfera inerte, in modo che la riduzione del gas possa essere somministrata senza la presenza di ossigeno:
SICL4(g) + 4na (l) => Sì (s) + 4Nacl (L)
È interessante notare che, con silicio amorfo, vengono fabbricati pannelli solari ad alte prestazioni energetiche.
Silicio cristallino
Ricominciando dalla silice in polvere o dal quarzo, vengono portati in un forno ad arco elettrico, dove reagisce con la coca cola. In questo modo, l'agente riducente non è più un metallo ma un materiale carbonaceo ad alta purezza:
Sio2(s) + 2c (s) => Sì (s) + 2co (g)
Nella reazione, viene anche prodotto carburo di silicio, SIC, che è neutralizzato con un eccesso di SIO2 (Ancora una volta il quarzo è eccessivamente):
2Sic (S) + SIO2(s) => 3SI (s) + 2co (g)
Un altro metodo per preparare il silicio cristallino è l'uso di alluminio come agente riducente:
3SIO2(s) + 4al (l) => 3SI (s) + 2al2O3(S)
E a partire dall'esafluorosilicato di potassio, K2[Sif6], viene anche reagito con alluminio metallico o potassio per causare lo stesso prodotto:
K2[Sif6] (l) + 4al (l) => 3Si (s) + 6kf (l) + 4alf3(G)
Immediatamente il silicio si dissolve in alluminio fuso e quando il sistema si raffredda, il primo si cristallizza e si separa dal secondo; cioè si formano cristalli di silicio, che sembrano colori grigiastri.
Silicio poliristalina
A differenza delle altre sintesi o produzioni, per ottenere il silicio poliristalina, inizia con una fase gassosa silano, SIH4. Questo gas subisce una pirolisi superiore a 500 ° C, in modo tale che si verifichi una decomposizione termica e quindi, i suoi vapori iniziali, finiscono per depositare poliristali di silicio su una superficie del semiconduttore.
La seguente equazione chimica esemplifica la reazione che ha luogo:
si4(g) => Sì (s) + H2(G)
Ovviamente, non ci dovrebbe essere ossigeno nella camera, in quanto reagirebbe con il SIH4:
si4(g) + 2 °2(g) => siO2(s) + 2h2O (g)
E la spontaneità della reazione a combustione è tale, che si verifica rapidamente a temperatura ambiente in faccia.
Un altro percorso sintetico per produrre questo tipo di silicio parte del silicio cristallino come materia prima. Lo fanno reagire con il cloruro di idrogeno a una temperatura di circa 300 ° C, in modo che il triclorosilano sia formato:
Può servirti: ferro (elemento): caratteristiche, struttura chimica, usiSì (s) + 3HCl (G) => SICL3H (G) + H2(G)
E il SICL3H reagisce a 1100 ºC per rigenerare il silicio, ma ora poliristaline:
4Sicl3H (G) => Sì (S) + 3SICL4(g) + 2h2(G)
È sufficiente vedere le equazioni per dare un'idea di lavoro e parametri di produzione rigorosi che devono essere considerati.
Isotopi
Il silicio è naturalmente e principalmente come isotopo 28Sì, con un'abbondanza del 92,23%.
Oltre a ciò, ci sono altri due isotopi che sono stabili e quindi non subiscono un decadimento radioattivo: il 29Sì, con un'abbondanza del 4,67%; E 30Sì, con un'abbondanza del 3,10%. Essere così abbondante 28Sì, non sorprende che il peso atomico del silicio sia 28.084 U.
Il silicio può anche essere in diversi radioisotopi, tra cui il 31Sì (T1/2= 2,62 ore) e 32Sì (T1/2= 153 anni). Altri (22Sì - 44Se hanno T1/2 molto breve o breve (meno di centesimi di secondi).
Rischi
Il silicio puro è una sostanza relativamente inerte, quindi di solito non si accumula in nessun organo o tessuto fintanto che l'esposizione ad esso è bassa. In forma di polvere può causare irritazioni per gli occhi, causando lacrime o arrossamento, pur toccandola può causare disagio della pelle, prurito e pelaggio.
Quando l'esposizione è molto alta, il silicio può danneggiare i polmoni; Ma senza effetti successivi, a meno che l'importo non sia sufficiente per causare soffocamento. Tuttavia, ciò non accade con il quarzo, che è associato a cancro al polmone e malattie come la bronchite ed enfisema.
Allo stesso modo, il silicio puro è in natura molto raro e i suoi composti, così abbondanti nella crosta terrestre, non rappresentano alcun rischio per l'ambiente.
Ora, rispetto agli organi, questi potrebbero essere tossici; Ma avere molti di essi dipendono da quale viene considerato uno, così come altri fattori (reattività, pH, meccanismo d'azione, ecc.).
Applicazioni
Industria di costruzioni
I minerali del silicio integrano la "pietra" con cui vengono costruiti edifici, case o monumenti. Ad esempio, cementi, cemento, stucco e mattoni refrattari, sono costituiti da miscele solide basate su silicati. Da questo approccio, si può apparire l'utilità che questo elemento ha nelle città e nell'architettura.
Vetro e ceramica
Dalla silice, possono essere fabbricati cristalli utilizzati su dispositivi ottici, sia come isolanti, cellule per campioni di spettrofotometri, cristalli piezoelettrici o semplici occhiali.
Inoltre, quando il materiale viene preparato con più additivi, finisce per trasformare in un solido amorfo, ben noto come vetro; e le montagne di sabbia sono generalmente la fonte di silice o quarzo necessaria per la sua produzione. D'altra parte, con i materiali in ceramica e porcellana in silicati sono fabbricati.
Idee intrecciate, il silicio è presente anche in artigianato e ornamenti.
Leghe
Gli atomi di silicio possono essere coesivi ed essere miscibili con una matrice di metallo, quindi è un additivo per numerose leghe o metalli; Ad esempio, acciaio, per produrre nuclei magnetici; bronzi, per la produzione di cavi telefonici; e alluminio, nella produzione di lega di alluminio-sailico per parti automobilistiche leggere.
Pertanto, non solo può essere trovato nella "pietra" degli edifici, ma anche nei metalli delle loro colonne.
Essiccanti
 Sfere di silice gelatinose, usate come essiccanti. Fonte: essiccanti [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Sfere di silice gelatinose, usate come essiccanti. Fonte: essiccanti [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] La silice, sotto forma di gel o amorfo, consente di produrre solidi che agiscono come essiccanti quando si prendono le molecole d'acqua che entrano nel contenitore e mantengono il loro interno asciutto.
Industria elettronica
 Il silicio poliristale e amorfo viene utilizzato per la produzione di pannelli solari. Fonte: pxhere.
Il silicio poliristale e amorfo viene utilizzato per la produzione di pannelli solari. Fonte: pxhere. Gli strati di silicio di diversi spessori e colori fanno parte di chip di computer, nonché con i loro solidi (cristallini o amorfi), sono stati progettati circuiti integrati e celle solari.
Essendo un semiconduttore, gli atomi sono incorporati con meno (Al, B, GA) o più elettroni (P, AS, SB) per trasformarlo in semiconduttori di tipo P O N, rispettivamente. Con due sindacati di silicios, uno N e l'altro P, Sono fabbricati diodi di emettitori di luce.
Polimeri di silicone
La famosa colla in silicone è costituita da un polimero organico supportato dalla stabilità delle catene dei collegamenti Si-O-Si ... Se queste catene sono molto lunghe, corte o reticolate, le proprietà del polimero silicone cambiano, nonché le loro applicazioni finali.
Tra i suoi usi, può essere menzionato quanto segue:
-Incorsi o adesivi, non solo per unire le carte, ma blocchi di costruzione, gomme, pannelli di vetro, rocce, ecc.
-Lubrificanti in sistemi di frenatura idraulica
-Rafforza i dipinti e migliora la luminosità e l'intensità dei loro colori, allo stesso tempo che consente di resistere alle variazioni di temperatura senza crack o carte
-Sono usati come spray idrico d'acqua, che rimane asciutti alcune superfici o oggetti
-Danno prodotti per l'igiene personale (pasta dentale, shampoo, gel, creme di rasoio, ecc.) La sensazione di essere setoso
-I suoi rivestimenti proteggono i componenti elettronici di dispositivi delicati da calore e umidità, come i microprocessori
-Con polimeri in silicone, alcune delle palline di gomma che rimbalzano vengono a malapena lasciate cadere sul pavimento.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Silicio. Recuperato da: in.Wikipedia.org
- Microchimici. (S.F.). Cristallografia del silicio. Recuperato da: microchimici.com
- Lentech b.V. (2019). Tabella del periodo: silicio. Recuperato da: lentech.com
- Marques Miguel. (S.F.). Si verifica il silicio. Recuperato da: Nautilus.Fis.Uc.Pt
- Più Hemant. (5 novembre 2017). Silicio. Recuperato da: Hemantmore.org.In
- Pilgaard Michael. (22 agosto 2018). Silicio: occorrenza, isolamento e sintesi. Recuperato da: pilgaardelegs.com
- Dottore. Doug Stewart. (2019). Fatti per elementi di silicio. Chemicool. Recuperato da: Chemicool.com
- Christiana Honsberg e Stuart Bowden. (2019). Una raccolta di risorse per l'educatore fotovoltaico. Pvecamento. Estratto da: pvecamento.org
- American Chemistry Council, Inc. (2019). Siliconi nella vita di tutti i giorni. Recuperato da: SEHSC.Americachemistry.com
- « Tipi ed esempi di strategie di distribuzione
- Tipi di strategia del prodotto, come è fatto e esempio »

