Storia di selenio, proprietà, struttura, ottenimento, usi

- 3215
- 207
- Benedetta Rinaldi
Lui selenio È una sostanza chimica non metallica che appartiene al gruppo 16 della tavola periodica ed è rappresentato dal simbolo è. Questo elemento ha proprietà intermedie tra zolfo e telurio, che sono membri dello stesso gruppo.
Il selenio fu scoperto nel 1817 da Jöhs J. Berzelius e John G. Gahn, che vaporizzò la pirite osservò un residuo rosso (immagine inferiore). Inizialmente lo hanno confuso con il Telurio, ma poi si sono resi conto che stavano affrontando un nuovo elemento.
 Una bottiglia con selenio rosso amorfo, il più noto alotropico per questo elemento. Fonte: w. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Una bottiglia con selenio rosso amorfo, il più noto alotropico per questo elemento. Fonte: w. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] Berzelius ha chiamato il nuovo elemento come selenio, basato sul nome di "Selene" che significa "Dea della luna". Il selenio è una traccia essenziale per piante e animali, sebbene ad alte concentrazioni sia un elemento tossico.
Il selenio ha tre forme allotropiche principali: rosso, nero e grigio. Quest'ultimo ha la proprietà di modificare la sua conduttanza elettrica in base all'intensità della luce che la irradia (fotoconduttore), quindi ha avuto molte applicazioni.
Il selenio è ampiamente distribuito nella crosta terrestre, tuttavia i minerali che lo contengono non sono abbondanti, quindi non c'è sfruttamento minerario di selenio.
Si ottiene principalmente come prodotto secondario del processo di raffinazione mediante elettrolisi di rame. Il selenio si accumula nella melma che si trova nell'anodo delle cellule di elettrolisi.
Gli esseri umani hanno circa 25 seleenoproteine, alcune delle quali soddisfano un'azione antiossidante e controllano la generazione di radicali liberi. Ci sono anche aminoacidi di selenio, come la selenomectionina e la selenocisteina.
[TOC]
Storia
Prima osservazione
L'alchimista Arnold di Villanova potrebbe aver osservato il selenio nel 1230. Questo si è formato in medicina nella Sorbona di Parigi ed era persino il dottore di Papa Clemente V.
Villanova nel suo libro Rosarium philosophorum Descrivi uno zolfo rosso o un "rossa di zolfo" che era rimasto in un forno dopo aver vaporizzato lo zolfo. Questo zolfo rosso avrebbe potuto essere un alotropico del selenio.
Scoperta
Nel 1817, Jöhs Jakob Berzelius e John Gottlieb Gahn scoprirono il selenio in una pianta chimica per la produzione di acido solforico, vicino a Gripsholm, Svezia. La materia prima per l'elaborazione dell'acido era la pirite, che estrae da una miniera di Falun.
Berzelius fu colpito dall'esistenza di un residuo rosso che rimase nel contenitore di piombo dopo che lo zolfo aveva bruciato.
Inoltre, Berzelius e Gahn hanno osservato che il residuo rosso aveva un forte odore di ravanello piccante, simile a quello presentato dal Telurio. Motivo per cui, ha scritto al suo amico Marect che credevano che il deposito osservato fosse un composto di Telurio.
Tuttavia, Blelius ha continuato ad analizzare il materiale depositato incenerindo la pirite e ha riconsiderato che Telurio non era stato trovato nel Falun. Concluso nel febbraio 1818 di aver scoperto un nuovo elemento.
Origine del tuo nome
Berzelius ha sottolineato che il nuovo elemento era una combinazione di zolfo e Telurio e che la somiglianza del Telurio con il nuovo elemento gli aveva dato l'opportunità di nominare la nuova sostanza di selenio.
Berzelio ha spiegato che "Tellus" significa dea della terra. Martin Klaport nel 1799 mise questo nome a Telurio e scrisse: “Nessun elemento è chiamato solo in quel modo. Doveva essere fatto!".
A causa della somiglianza del Telurio con la nuova sostanza, Berzelius la chiamò con la parola selenio, derivato dalla parola greca "Selene" che significa "dea della luna".
Sviluppo delle tue applicazioni
Nel 1873 Willoughby Smith scoprì che la conduttività elettrica presentata dal selenio dipendeva dalla luce che la irradiava. Questa proprietà ha permesso al selenio di avere numerose applicazioni.
Alexander Graham Bell nel 1979 ha usato il selenio nel suo fotophone. Il selenio produce una corrente elettrica proporzionale all'intensità della luce che la illumina, usando con misuratori di luce, meccanismi di sicurezza per l'apertura e la chiusura delle porte, ecc.
L'uso di raddrizzatori di selenio in elettronica iniziò dagli anni '30, con numerose applicazioni commerciali. Negli anni '70 fu soppiantato nei raddrizzatori per il silicio.
Nel 1957 fu scoperto che il selenio era un elemento essenziale per la vita dei mammiferi, poiché era presente negli enzimi che proteggono dall'ossigeno reattivo e dai radicali liberi. Inoltre, è stata scoperta l'esistenza di aminoacidi come la selenometionina.
Proprietà fisiche e chimiche
Aspetto
Ci sono diversi alotropi per il selenio, il loro aspetto fisico varia. Di solito è presentato come un solido rossastro sotto forma di polvere.
Peso atomico standard
78.971 u
Numero atomico (Z)
3. 4
Punto di fusione
221 ºC
Punto di ebollizione
685 ºC
Densità
La densità di selenio varia a seconda di cui viene considerato alotropico o polimorfo. Alcune delle sue densità determinate a temperatura ambiente sono:
Grigio: 4.819 g/cm3
ALFA: 4.39 g/cm3
Vitreous: 4,28 g/cm3
Stato liquido (punto di fusione): 3,99 g/cm3
Calore di fusione
Grigio: 6,69 kJ/mol
Calore di vaporizzazione
95,48 kJ/mol
Capacità calorica molare
25.363 J/(mol · K)
Numeri di ossidazione
Il selenio può essere collegato nei suoi composti che manifestano i seguenti numeri o stati di ossidazione: -2, -1, +1, +2, +3, +4, +5, +6. Tra questi, i più importanti sono -2 (2-), +4 (lo so4+) e +6 (lo so6+).
Può servirti: microscopio sempliceAd esempio, in SEO2 Il selenio ha un numero di ossidazione +4; cioè si assume l'esistenza del catione4+ (LUI4+O22-). Simile al SEO3 Il selenio ha un numero di ossidazione +6 (i6+O32-).
In idrogeno seleniuro, h2SE, il selenio ha un numero di ossidazione di -2; Cioè, ancora una volta, si presume che l'esistenza dello ione o l'anione2- (H2+LUI2-). Questo perché il selenio è più elettronegativo dell'idrogeno.
Elettronegatività
2,55 sulla scala Pauling.
Energia ionizzata
-Primo: 941 kJ/mol.
-Secondo: 2.045 kJ/mol.
-Terzo: 2.973,7 kJ/mol.
Ordine magnetico
Diamagnetico.
Durezza
2.0 sulla scala MOHS.
Isotopi
Esistono cinque isotopi naturali e stabili di selenio, che sono mostrati di seguito con le rispettive abbondanze:
-74SE (0,86%)
-76SE (9,23%)
-77SE (7,6%)
-78SE (23,69%)
-80SE (49,8%)
Alotropia
 Bottiglia nera ricoperta da un film sottile di selenio grigio. Fonte: w. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Bottiglia nera ricoperta da un film sottile di selenio grigio. Fonte: w. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] Il selenio preparato nelle reazioni chimiche è una polvere amorfa rossa in mattoni, che quando viene fondata la forma nera vitrea, simile ai resoconti di Rosario (immagine superiore). Il selenio nero è un solido fragile e brillante.
Inoltre, il selenio nero è leggermente solubile nel solfuro di carbonio. Quando questa soluzione viene riscaldata a 180 ºC, il selenio grigio precipita, è più stabile e denso alotropico.
Il selenio grigio è resistente all'ossidazione ed è inerte all'azione degli acidi non ossidanti. La proprietà principale di questo selenio è la sua fotoconduttività. Essere illuminati aumenta la sua conduttività elettrica di un fattore da 10 a 15 volte.
Reattività
Il selenio nei suoi composti esiste negli stati di ossidazione -2, +4 e +6. Manifesta una chiara tendenza a formare acidi in stati di ossidazione più elevati. I composti che hanno il selenio con lo stato di ossidazione -2 sono chiamati Seleniuros (2-).
Reazione di idrogeno
Il selenio reagisce con l'idrogeno per formare l'idrogeno seleniuro (H2Se), un gas incolore, infiammabile e puzzolente.
Reazione di ossigeno
Il selenio brucia emettendo una fiamma blu e formando biossido di selenio:
LUI8 (s) + 8 o2 => 8 SEO2 (S)
L'ossido di selenio è una sostanza polimerica, bianca e solida. La sua idratazione produce acido selenoso (h2Seo3). Il selenio forma anche trioxide di selenio (SEO3), Analogo allo zolfo (così3).
Reazione con alogeni
Il selenio reagisce con il fluoruro per formare il selenio hexafluororo:
LUI8 (s) +24 f2 (g) => 8 sef6 (L)
Il selenio reagisce con il cloro e il bromo per formare il dicloruro e il dipromure del dicloruro, rispettivamente:
LUI8 (s) +4 CL2 => 4 SE2Cl2
LUI8 (s) +4 BR2 => 4 SE2Br2
Il selenio può anche formare SEF4 e secl4.
D'altra parte, il selenio forma composti in cui un atomo di selenio si unisce a uno di alogeno e un altro di ossigeno. Un esempio importante è il selenio ossicloruro (SEO2Cl2), Con selenio in ossidazione +6, un solvente estremamente potente.
Reazione con i metalli
Il selenio reagisce con i metalli per formare alluminio, cadmio e sodio seleniuros. La sostanza chimica del di sotto corrisponde alla formazione dell'alluminio seleniuro:
3 SE8 + 16 al => 8 a2LUI3
Selenitas
Il selenio forma sali noti come Selenitas; Ad esempio: Silver Selenite (AG2Seo3) e selenite di sodio (NA2Seo3). Questo nome è stato usato, in un contesto letterario, per riferirsi agli abitanti della luna: le Selenitas.
Acidi
L'acido selenio più importante è l'acido sigillo (h2Seo4). È forte come l'acido solforico ed è più facilmente ridotto.
Struttura elettronica e configurazione
- Il selenio e i suoi collegamenti
Il selenio ha sei elettroni di Valencia, motivo per cui si trova nel gruppo 16, lo stesso dell'ossigeno e dello zolfo. Questi sei elettroni si trovano in orbitali 4S e 4p, secondo la loro configurazione elettronica:
[AR] 3D10 4s2 4p4
Pertanto, come lo zolfo, formano due legami covalenti per completare il suo ottetto di Valencia; Sebbene abbia la disponibilità dei suoi orbitali 4D per collegare più di due atomi. Pertanto, tre atomi di selenio si avvicinano e formano due legami covalenti: se-se-se.
Il selenio con la sua maggiore massa atomica ha la naturale tendenza a formare strutture governate da legami covalenti; Invece di essere disposti come molecole diatomiche2, Se = se, analogo a o2, O = O.
- Anelli o catene
Tra le strutture molecolari adottate dagli atomi di selenio, due possono essere menzionate in termini generali: anelli o catene. Si noti che nel caso ipotetico della SE3, Gli atomi sono ancora richiesti alle estremità; Pertanto, devono collegarsi ad altri atomi, successivamente, fino a quando la catena non può essere chiusa in un anello.
Gli anelli più comuni sono quelli di otto membri o atomi di selenio:8 (Una corona di selite). Perché otto? Perché più piccolo è l'anello, maggiore sarà la tensione; Cioè, gli angoli dei loro collegamenti si discostano dai valori naturali impostati dalle loro ibridazioni SP3 (Simile come con i cicloalcani).
Può servirti: siringa PascalCi sono otto atomi, la separazione tra gli atomi di SE è sufficiente affinché i loro collegamenti siano "rilassati" e non "piegati"; Sebbene l'angolo dei suoi collegamenti sia 105,7 e non 109.5. D'altra parte, potrebbero esserci anelli più piccoli: io6 E7.
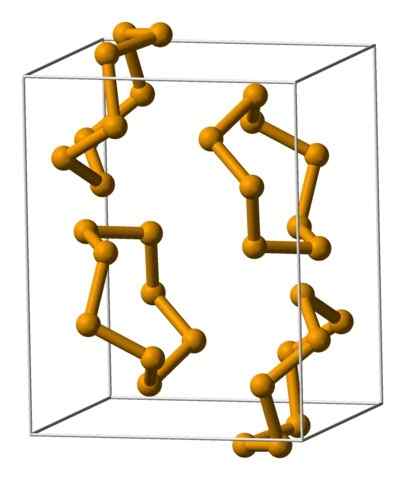 Unità di selenio analreste rappresentate con un modello di sfere e barre. Fonte: Benjah-BMM27 [dominio pubblico].
Unità di selenio analreste rappresentate con un modello di sfere e barre. Fonte: Benjah-BMM27 [dominio pubblico]. Nell'immagine superiore sono mostrate le unità Analeres8. Nota la somiglianza che hanno con le corone di zolfo; Solo loro sono più grandi e pesanti.
Oltre agli anelli, gli atomi di selenio possono anche essere disposti in catene elicoidali (pensa alle scale di lumache):
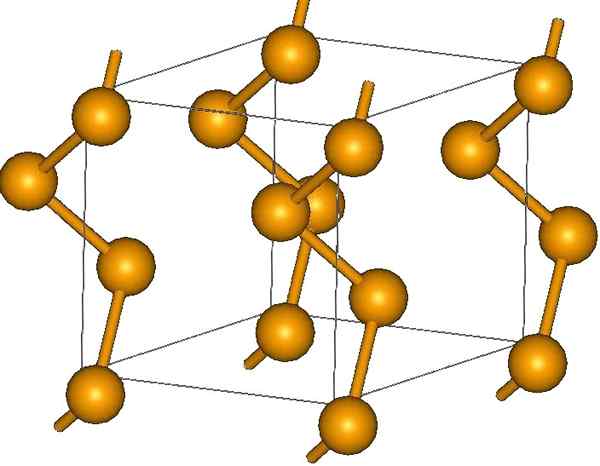 Catene di selenio elicoidale. Fonte: MaterialScientist presso l'inglese Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Catene di selenio elicoidale. Fonte: MaterialScientist presso l'inglese Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] Alla sua estremità ci possono essere collegamenti a doppio terminale (-se = se) o gli anelli lo sono8.
- Alotropi
Tenendo conto che potrebbero esserci anelli o catene elicoidali di selenio e che le loro dimensioni possono anche variare a seconda del numero di atomi che contengono, quindi è evidente che esiste più di un alotropico per questo elemento; Questo è solidi di selenio puri ma con diverse strutture molecolari.
Selenio rosso
Tra gli allotropi più importanti di selenio abbiamo il rosso, che possono essere presentati come una polvere amorfa, o come cristalli monoclinici e polimorfici (vedi immagine degli anelli sono8).
Nel selenio rosso amorfo, le strutture sono disordinate, senza modelli apparenti; Mentre si trova nell'obiettivo, gli anelli stabiliscono una struttura monoclinica. Il selenio rosso cristallino è polimorfico, con tre fasi: α, β e γ, che differiscono nelle loro densità.
Selenio nero
La struttura del selenio nero è anche costituita da anelli; Ma non otto membri, ma molti altri, ci sono anelli di mille atomi (1000). Si dice quindi che la sua struttura sia complessa ed è costituita da anelli polimerici; alcuni più grandi o piccoli di altri.
Quando ci sono anelli polimerici di diverse dimensioni, è difficile attendere che un ordine strutturale si stabilisca; Quindi anche il selenio nero è amorfo, ma in contrasto con la polvere rossastra menzionata sopra, ha contestimenti vetrosi, sebbene sia fragile.
Selenio grigio
E infine, dei più semplici alotropi del selenio è grigio, che si distingue sopra gli altri essendo il più stabile in condizioni normali e anche con un aspetto metallico.
I loro cristalli possono essere esagonali o trigonali, stabiliti dalle forze di dispersione di Londra tra le loro catene elicoidali polimeriche (immagine superiore). L'angolo dei suoi collegamenti è 130,1 º, che indica una deviazione positiva degli ambienti tetraedrici (con angoli di 109,5 °).
Ecco perché le catene elicoidali di selenio danno l'impressione di essere "aperti". Attraverso il chiarimento, in questa struttura gli atomi si affrontano, quindi in teoria ci deve essere una maggiore sovrapposizione dei loro orbitali per creare bande di guida.
Il calore con l'aumento delle vibrazioni molecolari danneggia queste bande quando le catene sono disordinate; Mentre l'energia di un fotone colpisce direttamente gli elettroni, li eccita e promuove le loro transazioni. Da questa visione è "facile" immaginare la fotoconduttività per il selenio grigio.
Dov'è e produzione
Sebbene sia ampiamente distribuito, il selenio è un elemento raro. È nello stato nativo associato a zolfo e minerali come Eucairita (Cuagse), Cloustalita (PBSE), Naumanite (AG AG2SE) e Crookesite [(Cutiag)2LUI].
Il selenio si trova come un'impurità che sostituisce lo zolfo in una piccola porzione di minerali solforosi metallici; come rame, piombo, argento, ecc.
Ci sono terreni in cui esiste il selenio nella forma solubile di selenato. Questi sono trasportati dalle acque delle piogge ai fiumi e da lì verso l'oceano.
Alcune piante sono in grado di assorbire e concentrare il selenio. Ad esempio, una tazza di noci in Brasile contiene 544 µg di selenio, una quantità equivalente al 777% della quantità di selenio raccomandato quotidianamente.
Negli esseri viventi, il selenio si trova in alcuni aminoacidi, come: selenometionina, selenocisteina e metilselenocisteina. Selenocisteina e selenite sono ridotti all'idrogeno seleniuro.
Elettrolisi di rame
Non c'è sfruttamento minerario di selenio. La maggior parte è ottenuta come prodotto secondario del processo di raffinazione mediante elettrolisi di rame, essendo nel limo che si accumula nell'anodo.
Il primo passo consiste nella produzione di biossido di selenio. Per questo, l'anodico slim con carbonato di sodio viene trattato per produrre la sua ossidazione. Quindi l'ossido di selenio viene aggiunto acqua ed è acidificato per formare l'acido selenico.
Infine, è l'acido selenoso con biossido di zolfo per produrre la sua riduzione e ottenere il selenio elementare.
In un altro metodo nella miscela di limo e fango formato nella produzione di acido solforico, si ottiene un selenio rosso impuro che si dissolve in acido solforico.
Vengono quindi formati acido di selenario e acido ventre. Questo acido selenoso riceve lo stesso trattamento del metodo precedente.
È inoltre possibile utilizzare il cloro, che agisce su seleniuros metallici per produrre composti clorati di selenio volatili; come: lo so2Cl2, Secl4, Secl2 e seocl2.
Può servirti: livello chimicoQuesti composti, in un processo condotto nell'acqua, diventano acido selenoso, che viene trattato con biossido di zolfo per rilasciare selenio.
Carta biologica
Carenza
Il selenio è una traccia essenziale per piante e animali, la cui carenza nell'uomo ha causato gravi disturbi come la malattia di Keshan; Una malattia caratterizzata da danni miocardici.
Inoltre, la carenza di selenio è associata all'infertilità maschile e può svolgere un ruolo nella malattia di Kashin-Beck, un tipo di osteoartrite. Allo stesso modo, è stata osservata una carenza di selenio nell'artrite reumatoide.
Cofattore enzimatico
Il selenio è un componente di enzimi con azione antiossidante, come la glutation perossidasi e la tioresodossina reduttasi che agiscono nell'eliminazione di sostanze con ossigeno reattivo.
Inoltre, il selenio è un cofattore di ormoni tiroidei desiodinasi. Questi enzimi sono importanti nel regolare il funzionamento degli ormoni tiroidei.
L'uso del selenio è stato indicato nel trattamento della malattia di Hasimoto, una malattia autoimmune con la formazione di anticorpi contro le cellule tiroidee.
Il selenio è stato anche usato per ridurre gli effetti tossici del mercurio, poiché alcune delle sue azioni sono esercitate su enzimi antiossidanti dipendenti dal selenio.
Proteine e aminoacidi
L'uomo ha circa 25 seleenoproteine che esercitano un'azione antiossidante per la protezione contro lo stress ossidativo, iniziata da un eccesso di specie reattive di ossigeno (ROS) e specie reattive azoto (NI).
È stata rilevata la presenza di aminoacidi selenometiocina e selenocisteina nell'uomo. La selenomectionina viene utilizzata come integratore alimentare nel trattamento degli stati di carenza di selenio.
Rischi
Un'alta concentrazione del corpo di selenio può avere numerosi effetti dannosi sulla salute, a partire da capelli fragili e unghie fragili, a eruzioni cutanee, calore, edema della pelle e forte dolore.
Quando si tratta di selenio in contatto con gli occhi, le persone possono esprimere ardore, irritazione e lacrima. Nel frattempo, l'esposizione prolungata a un fumo con un alto contenuto di selenio, può causare edema polmonare, respiro aglio e bronchite.
Inoltre, la persona può sperimentare polmonite, nausea, brividi, febbre, dolore alla gola, diarrea ed epatomegalia.
Il selenio può interagire con altri medicinali e integratori alimentari, come antiacidi, farmaci antineoplastici, corticosteroidi, niacina e pillole per il controllo delle nascite.
Il selenio è stato associato ad un aumentato rischio di contrarre il cancro della pelle. In uno studio del National Cancer Institute, è stato sottolineato che gli uomini con alta concentrazione del corpo di selenio avevano il doppio della probabilità di soffrire di carcinoma prostatico aggressivo.
Uno studio indica che l'assunzione giornaliera di 200 µg di selenio aumenta del 50% la possibilità di sviluppare un diabete di tipo II.
Applicazioni
Cosmetici
Il solfuro di selenio viene utilizzato nel trattamento della seborrea, nonché grasso o forfora.
Medici
È usato come medicina alternativa nel trattamento della malattia di Hasimoto, una malattia della tiroide autoimmune.
Il selenio riduce la tossicità del mercurio, la cui una delle sue attività tossiche viene esercitata sugli enzimi desossidanti, che usano il selenio come cofattore.
Elettrolisi del manganese
L'uso dell'ossido di selenio nell'elettrolisi del manganese riduce considerevolmente i costi della tecnica, poiché il consumo elettrico diminuisce.
Pigmento
Il selenio è usato come pigmento in dipinti, materie plastiche, ceramiche e vetro. A seconda del selenio usato, il colore del vetro varia da un rosso intenso a un arancione chiaro.
Fotoconduttivo
A causa della proprietà del selenio grigio di cambiare la sua conduttività elettrica a seconda dell'intensità della luce che la irradia, il selenio è stato usato in fotocopiatrici, fotocoprieri, fotometri e celle solari.
L'uso del selenio nei fotocopiatrici era una delle principali applicazioni di selenio; Ma l'aspetto dei fotoconduttori organici ha ne è diminuito l'uso.
Cristalli
Il selenio viene utilizzato per lo scolorimento del vetro, a seguito della presenza di ferro che produce una colorazione verde o gialla. Inoltre, consente una colorazione rossa di vetro, a seconda dell'uso che si desidera dargli.
Vulcanizzazione
Dietenio Dietenium è usato come agente vulcanizzante dei prodotti in gomma.
Leghe
Il selenio è usato in combinazione con il bismuto in ottone, al fine di sostituire il piombo; Elemento molto tossico che ne ha ridotto l'uso a causa delle raccomandazioni delle agenzie sanitarie.
Il selenio viene aggiunto a basse concentrazioni in leghe in acciaio e rame per migliorare la facilità d'uso di questi metalli.
Rettificatori
I raddrizzatori di selenio iniziarono ad essere usati nel 1933 fino agli anni '70, quando furono sostituiti dal silicio a basso costo e di qualità superiore.
Riferimenti
- Royal Australian Chemical Institute. (2011). Selenio. [PDF]. Recuperato da: rachi.org.Au
- Wikipedia. (2019). Selenio. Recuperato da: in.Wikipedia.org
- Sato Kentaro. (S.F.). Nuovi allotropi di elementi di gruppo principali. [PDF]. Estratto da: tcichemicals.com
- Dottore. Impasto Stewart. (2019). Fatti per elementi di selenio. Chemicool. Recuperato da: Chemicool.com
- Robert C. Brastato. (28 agosto 2019). Selenio. Encyclopædia Britannica. Recuperato da: Britannica.com
- Marques Miguel. (S.F.). Selenio. Recuperato da: Nautilus.Fis.Uc.Pt
- Helmestine, Anne Marie, PH.D. (3 luglio 2019). Fatti di selenio. Recuperato da: Thoughtco.com
- Lentech b. V. (2019). Tabella del periodo: selenio. Recuperato da: lentech.com
- Tinggi u. (2008). Selenio: il suo ruolo di antiossidante nella salute umana. Salute ambientale e prevenire la medicina, 13(2), 102-108. Doi: 10.1007/S12199-007-0019-4
- Ufficio degli integratori alimentari. (9 luglio 2019). Selenio: foglio di fatti per gli operatori sanitari. National Institute of Health. Estratto da: SDG.Od.NIH.Gov

