Rubido historia, proprietà, struttura, ottenimento, usi

- 4464
- 927
- Benedetta Rinaldi
Lui rubidio È un elemento metallico che appartiene al gruppo 1 della tabella periodica: quello dei metalli alcalini, rappresentati dal simbolo chimico RB. Il suo nome suona come Rubí, ed è perché quando è stato scoperto il suo spettro di emissione, ha mostrato linee caratteristiche rosse intense.
È uno dei metalli più reattivi esistenti. È il primo dei metalli alcalini che, nonostante sia un po 'denso, affonda nell'acqua. Reagisce anche con lei in modo più esplosivo rispetto al litio, al sodio e al potassio. Ci sono stati esperimenti in cui le ampoule sono memorizzate (l'immagine inferiore) per cadere ed esplodere nelle vasche da bagno.
 Ampoule con un grammo di rubidio immagazzinato in un'atmosfera inerte. Fonte: immagini ad alta risoluzione degli elementi chimici [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)]
Ampoule con un grammo di rubidio immagazzinato in un'atmosfera inerte. Fonte: immagini ad alta risoluzione degli elementi chimici [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)] Rubido si distingue essendo un metallo più costoso dello stesso oro; Non tanto per la sua carenza, ma per la sua ampia distribuzione mineralogica nella crosta terrestre e le difficoltà che si verificano quando lo si isola di potassio e cessare i composti.
Mostra una chiara tendenza ad associare al potassio nei suoi minerali, trovando come impurità. Non solo nella materia geochimica forma un duo con potassio, ma anche nel campo della biochimica.
L'organismo "confonde" gli ioni K+ Per quelli di RB+; Tuttavia, Rubido non è un elemento essenziale fino ad oggi, poiché non è noto quale ruolo abbia nel metabolismo. Anche così, gli integratori di Rubidium sono stati usati per alleviare alcune condizioni mediche come la depressione e l'epilessia. D'altra parte, entrambi gli ioni sparano una fiamma viola nel calore dell'accendino.
A causa del suo costo elevato, le sue applicazioni non si basano troppo nella sintesi di catalizzatori o materiali, ma come componente per vari dispositivi con basi teoriche fisiche. Uno di questi è l'orologio atomico, le celle solari e i magnetometri. Ecco perché a volte il rubidio viene preso come un metallo sottovalutato o piccolo studiato.
[TOC]
Storia
Il rubido fu scoperto nel 1861 dai chimici tedeschi Robert Bunsen e Gustav Kirchhoff, usando la spettroscopia. Per fare ciò, hanno usato il Bunsen Accendino e lo Spettroscopio, inventato due anni prima, oltre alle tecniche di precipitazione analitiche. Il suo oggetto di studio era il minerale di lepidolite, il cui mostra la collezione di Sassonia, Germania.
Hanno iniziato da 150 kg di minerale di lepidolite, che trattavano con acido cloroplatinico, H2Ptcl6, Per precipitare il potassio esacloroplatinato, k2Ptcl6. Tuttavia, quando hanno studiato il loro spettro bruciandolo nel Bunsen più leggero, si sono resi conto che hanno mostrato linee di emissione che non coincidevano da allora con nessun altro elemento.
Lo spettro di emissione di questo nuovo elemento è caratterizzato da due linee ben definite nella regione rossa. Ecco perché è stato battezzato con il nome "Rubido" che significa "rosso scuro". Quindi, Bunsen e Kirchhoff sono riusciti a separare l'RB2Ptcl6 di k2Ptcl6 mediante cristallizzazione frazionata; Per ridurlo finalmente al sale del cloruro usando l'idrogeno.
Identificato e isolato un sale del nuovo elemento di rubidio, i chimici tedeschi dovevano solo ridurlo al loro stato metallico. Per raggiungere questo obiettivo, hanno provato in due modi: applicare l'elettrolisi al cloruro di rubidio o riscaldare un sale facile da ridurre, come Tartrato. Così, è nato il Rubidio metallico.
Proprietà fisiche e chimiche
Aspetto
Metallo grigio argento. È così morbido che sembra un burro. Di solito è imballato all'interno di ampoule di vetro, all'interno delle quali predomina un'atmosfera inerte che la protegge dalla reazione di aria.
Numero atomico (Z)
37
Massa molare
85.4678 g/mol
Punto di fusione
39 ºC
Punto di ebollizione
688 ºC
Densità
A temperatura ambiente: 1.532 g/cm3
Al punto di fusione: 1,46 g/cm3
La densità del rubidio è superiore a quella dell'acqua, quindi affonderà mentre reagirà violentemente con esso.
Calore di fusione
2,19 kJ/mol
Calore di vaporizzazione
69 kJ/mol
Elettronegatività
0,82 sulla scala Pauling
Affinità elettronica
46,9 kJ/mol
Energie di ionizzazione
-Primo: 403 kJ/mol (RB+ gassoso)
-Secondo: 2632,1 KJ/mol (RB2+ gassoso)
-Terzo: 3859,4 kJ/mol (RB3+ gassoso)
Radio atomica
248 pm (empirico)
Conduttività termica
58.2 W/(M · K)
Resistività elettrica
128 nω · m a 20 ° C
Durezza MOHS
0.3. Pertanto, anche il talco è più duro di Rubidio metallico.
Reattività
 Prove di fiamma per Rubidio. Quando reagisce, salutano una fiamma viola. Fonte: Didaktische.Medien [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Prove di fiamma per Rubidio. Quando reagisce, salutano una fiamma viola. Fonte: Didaktische.Medien [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] Rubido è uno dei metalli alcalini più reattivi, dopo Cesio e Francia. È a malapena esposto all'aria inizia a bruciare, e se è buco, spara scintille luminose. Se è riscaldato, emette anche una fiamma viola (immagine superiore), che è un test positivo per gli ioni RB+.
Può servirti: Ididio 192Reagisce con l'ossigeno per formare una miscela di perossidi (RB2O2) e superossidi (RBO2). Sebbene non reagisca con acidi e basi, lo viola con acqua, generando idrossido di rubidio e idrogeno:
RB (s) + H2O (l) => rboh (AC) + H2(G)
Reagisce con l'idrogeno per formare l'idruro corrispondente:
RB (s) + H2(g) => 2rbh (s)
E anche con alogeni e zolfo in modo esplosivo:
2RB (S) + CL2(g) => RBCL (S)
2RB (s) + s (l) => rb2H.H)
Sebbene Rubidio non sia considerato un elemento tossico, è potenzialmente pericoloso e rappresenta i rischi del fuoco quando entra in contatto con acqua e ossigeno.
Struttura elettronica e configurazione
Gli atomi di rubidio sono disposti in modo tale da stabilire un cristallo cubico centrato nel corpo (BCC). Questa struttura è caratteristica per i metalli alcalini, che sono leggeri e tendono a galleggiare sull'acqua; Tranne il Rubidium Down (Cesio e France).
Nei cristalli di Rubido BCC, i loro atomi RB interagiscono tra loro grazie al collegamento metallico. Ciò è governato da un "mare di elettroni" del suo strato di valenza, dall'orbitale 5S secondo la sua configurazione elettronica:
[Kr] 5s1
Tutti gli orbitali 5S con il loro unico elettrone si sovrappongono in tutte le dimensioni dei cristalli di metallo rubido. Tuttavia, queste interazioni sono deboli, perché quando il gruppo di metalli alcalini scende, gli orbitali diventano più diffusi e, quindi, il collegamento metallico si indebolisce.
Ecco perché il punto di fusione dello rubidio è di 39 ºC. Inoltre, il suo debole legame metallico spiega la morbidezza del suo solido; Così morbido che sembra essere un burro d'argento.
Non ci sono abbastanza informazioni bibliografiche sul comportamento dei loro cristalli sotto elevate pressioni; Se ci sono fasi più dense con proprietà uniche come con sodio.
Numeri di ossidazione
La sua configurazione elettronica indica una volta che il rubidio tende fortemente a perdere il suo unico elettrone per diventare gas Kripton da isolamento a nobile. Quando lo fa, il catione monovalente si forma Rb+. Si dice che nei suoi composti ha il numero di ossidazione +1 quando si assume l'esistenza di questo catione.
A causa della tendenza del rubidio di ossidare, il presupposto che ci siano ioni RB+ Nei suoi composti ha successo, il che a sua volta indica il carattere ionico di questi composti.
In quasi tutti i composti del rubidio questo mostra un numero di ossidazione di +1. Esempi di essi sono i seguenti:
-Cloruro rubido, RBCL (RB+Cl-)
-Rubido idrossido, RBOH (RB+ OH-)
-Rubido carbonato, RB2Co3 (RB2+Co32-)
-Rubido Monossido, RB2O (Rb2+O2-)
-Rubidio Superossido, RBO2 (RB+O2-)
Anche se è molto raro, il rubidio potrebbe anche avere un numero di ossidazione negativa: -1 (RB-). In questo caso, parleremmo di un "rubidiuro" se formasse un composto con un elemento meno elettronegativo di lui, o se si presentasse in condizioni speciali e rigorose.
Gruppi
Ci sono composti in cui ogni atomo RB ha numeri di ossidazione con valori frazionari. Ad esempio, in RB6O (Rb62+O2-) e Rb9O2 (RB94+O22-) Il carico positivo è distribuito tra un insieme di atomi RB (cluster). Quindi, nell'RB6O il numero di ossidazione in teoria sarebbe +1/3; mentre in RB9O2, + 0.444 (4/9).
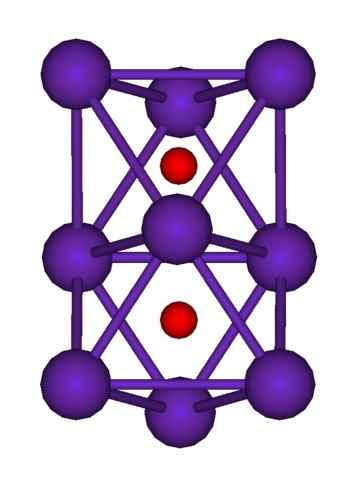 Struttura del cluster RB9O2. Fonte: Axiosaurus [dominio pubblico]
Struttura del cluster RB9O2. Fonte: Axiosaurus [dominio pubblico] La struttura del cluster RB è mostrata sopra9O2 rappresentato da un modello di sfere e barre. Nota come gli atomi di nove RB "racchiudono" gli anioni o2-.
A titolo di elucubazione, è come se una parte dei cristalli di metallo originale del rubidio rimanesse inalterata mentre si separava dal cristallo madre. Perdono elettroni nel processo; quelli necessari per attirare il o2-, e la carica positiva risultante è distribuita tra tutti gli atomi di detto cluster (set o aggregati di atomi RB).
Pertanto, in questi cluster di rubidio, l'esistenza di RB non può essere formalmente assunta+. Il RB6O e rb9O2 Classificano come subossidi di rubidio, in cui questa apparente anomalia è soddisfatta per avere un eccesso di atomi di metallo in relazione agli ossidi anioni.
Dov'è e ottieni
crosta terrestre
 Campione minerale lepidolite. Fonte: Rob Lavinsky, Irocks.Com-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Campione minerale lepidolite. Fonte: Rob Lavinsky, Irocks.Com-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] Rubido è l'elemento più abbondante 23 della crosta terrestre, con un'abbondanza paragonabile a quella di metalli di zinco, piombo, cesio e rame. Il dettaglio è che i loro ioni sono ampiamente diffusi, quindi non predomina in nessun minerale come elemento metallico principale e anche i loro minerali sono scarsi.
Può servirti: reagente Grignard: preparazione, applicazioni, esempiÈ per questo motivo che Rubido è un metallo molto costoso, anche più dello stesso oro, poiché il suo processo di ottenimento dalle sue mena è complesso a causa della difficoltà del suo sfruttamento.
In natura, data la sua reattività, Rubidio non è in uno stato nativo, ma come ossido (RB2O), cloruro (RBCL) o accompagnato da altri anioni. Sono ioni RB "gratuiti"+ Sono nei mari con una concentrazione di 125 µg/L, nonché nelle sorgenti calde e nei fiumi.
Tra i minerali della crosta terrestre che la contengono in una concentrazione inferiore all'1%:
-Leucita, K [ALSI2O6"
-Polucita, CS (sì2Ciao6· NH2O
-Carnita, kmgcl3· 6h2O
-Zinnwaldita, Klifeal (ALSI3)O10(Oh, f)2
-Amazonita, PB, Kalsi3O8
-Petalita, Lialsi4O10
-Biotita, K (MG, Faith)3Alsi3O10(Oh, f)2
-Rubiclina, (RB, K) ALSI3O8
-Lepidolita, K (Li, Al)3(Sì, al)4O10(F, oh)2
Associazione geochimica
Tutti questi minerali condividono una o due cose in comune: sono silicati di potassio, cesio o litio o sono sali minerali di questi metalli.
Ciò significa che Rubido ha una forte tendenza ad associare al potassio e al Cesio; Può anche sostituire il potassio durante la cristallizzazione di minerali o rocce, come accade nei campi delle pegmatita quando il magma cristallizza. Pertanto, Rubido è un sottoprodotto dello sfruttamento e della raffinazione di queste rocce e dei loro minerali.
Rubido può anche essere in rocce comuni come granito, argille e basalto e persino depositi carboniferi. Di tutte le fonti naturali, la lepidolite rappresenta il suo minerale principale e da cui viene sfruttato commercialmente.
Nella carnate, d'altra parte, Rubido può essere trovato come impurità RBCL con un contenuto dello 0,035%. E in maggiore concentrazione ci sono i depositi di poluitas e rubiclinas, che possono avere fino al 17% di rubidio.
La sua associazione geochimica con potassio è dovuta alla somiglianza delle sue radio ioniche; Il RB+ è più grande di k+, Ma la differenza nelle dimensioni non è un impedimento per il primo a sostituire il secondo nei suoi cristalli minerali.
Cristallizzazione frazionaria
Che si basi sulla lepidolite o la policita, o uno qualsiasi dei minerali sopra menzionati, la sfida rimane la stessa in misura maggiore o minore: separare il rubidio dal potassio e dal cessium; Cioè, applica tecniche di separazione delle miscele che consentono i composti o i sali di rubidio da un lato e quelli di potassio e cesio, dall'altro.
Questo è difficile dal momento che questi ioni (k+, Rb+ e CS+) condividere una grande somiglianza chimica; Reagiscono allo stesso modo per formare gli stessi sali, che differiscono a malapena l'uno dall'altro grazie alle loro densità e solubilità. Ecco perché viene utilizzata la cristallizzazione frazionata, in modo che possano lentamente e controllate.
Ad esempio, questa tecnica viene utilizzata per separare una miscela di carbonati e allume da questi metalli. I processi di ricristallizzazione devono essere ripetuti più volte per garantire cristalli finali e liberi di ioni coprecipitati; Un sale di rubidio che si cristallizza con i ioni K+ o CS+ sulla sua superficie o all'interno.
Tecniche più moderne, come l'uso di una resina di scambio ionico, o corone come agenti complessi, consentono anche gli ioni RB+.
Elettrolisi o riduzione
Una volta che è stato possibile separare e purificare il sale rubido, il prossimo e ultimo passo è ridurre i cationi Rb+ al metallo solido. Per fare ciò, il sale si scioglie ed è soggetto all'elettrolisi per precipitare rubidio nel catodo; o viene utilizzato un forte agente riducente, come il calcio e il sodio, in grado di perdere rapidamente gli elettroni e quindi ridurre il rubidio.
Isotopi
Rubido si trova sulla Terra come due isotopi naturali: il 85RB e 87Rb. Il primo ha un'abbondanza del 72,17%, mentre il secondo del 27,83%.
Lui 87RB è responsabile che questo metallo sia radioattivo; Tuttavia, le sue radiazioni sono innocue e persino benefiche per l'analisi degli appuntamenti. La tua mezza vita (T1/2) è 4,9 · 1010 anni, il cui periodo di tempo supera l'età dell'universo. Quando decade, diventa l'isotopo stabile 87Sig.
Grazie a questo, questo isotopo è stato usato fino ad oggi all'età di minerali e rocce di terra presenti dall'inizio della Terra.
Oltre agli isotopi 85RB e 87RB, ci sono altri sintetici e radioattivi con tempi di vita variabili e molto più brevi; Ad esempio, lui 82RB (T1/2= 76 secondi), 83RB (T1/2= 86,2 giorni), 84RB (T1/2= 32,9 giorni) e 86RB (T1/2= 18,7 giorni). Di tutti loro, il 82RB è il più utilizzato negli studi medici.
Rischi
Metallo
Rubido è un metallo così reattivo che deve essere conservato in ampoule di vetro sotto un'atmosfera inerte in modo che non reagisca con l'ossigeno dell'aria. Se detti rompe di AMPOULE, il metallo può essere inserito in cherosene o olio minerale per proteggerlo; Tuttavia, finirà per ossidare l'ossigeno disciolto in loro, dando origine a perossidi di rubidio.
Può servirti: sodio cianuro (NACN): struttura, proprietà, rischi, usiSe al contrario è stato deciso di posizionarlo sul legno, ad esempio, finirà per bruciare con una fiamma viola. Se c'è molta umidità, brucerà con il semplice fatto di essere esposto all'aria. Quando un grande pezzo di rubidio viene evitato a un volume di acqua, sfrutta vigorosamente, raggiungendo l'idrogeno prodotto sul fuoco in fiamme.
Pertanto, il rubidio è un metallo che dovrebbe manipolare, poiché tutte le sue reazioni sono praticamente esplosive.
Ioni
A differenza del Rubidio metallico, i suoi ioni RB+ Non rappresentano alcun rischio apparente per gli esseri viventi. Questi sciolti in acqua interagiscono con le cellule allo stesso modo degli ioni K+.
Pertanto, il rubidio e il potassio hanno comportamenti biochimici simili; Tuttavia, Rubidio non è un elemento essenziale, mentre il potassio sì. In questo modo, quantità apprezzabili di RB+ Possono accumularsi negli interni delle cellule, dei globuli rossi e dei visceri senza avere un impatto negativo sul corpo di qualsiasi animale.
In effetti, è stato stimato che un uomo adulto con una massa di 80 kg contenga circa 37 mg di rubidio; E che inoltre, un aumento di questa concentrazione nell'ordine da 50 a 100 volte non porta a sintomi indesiderabili.
Tuttavia, un eccesso di ioni RB+ può finire per trasferirsi in k ioni+; E di conseguenza, l'individuo subirà spasmi muscolari molto forti fino alla morte.
Logicamente, i sali di salvor o i composti di rubidio possono innescarlo immediatamente, quindi nessuno di loro dovrebbe essere ingerito. Inoltre, può causare semplici ustioni di contatto e tra i fluoruro (RBF) più tossici (RBF), l'idrossido (RBOH) e il cianuro (RBCN) di Rubidium.
Applicazioni
Collezionista di gas
Rubido è stato usato per catturare o eliminare le tracce di gas che possono esistere nei tubi sigillati sotto vuoto. Proprio a causa della loro alta tendenza a catturare ossigeno e umidità in essi, li eliminano sulla loro superficie come perossidi.
Pirotecnica
Quando i sali di rubidio bruciano una fiamma caratteristica da viola-viola. Alcuni fuochi d'artificio hanno questi sali nella loro composizione in modo da esplodere con questi colori.
Supplemento
Rubido cloruro è stato prescritto per combattere la depressione, poiché gli studi hanno determinato un deficit di questo elemento negli individui che soffrono di questa condizione medica. È stato anche usato come sedativo e per trattare l'epilessia.
Condensa di bose-einstein
Gli atomi di isotopo 87RB sono stati usati per creare la prima condensa di Bose-Einstein. Questo stato di materia è che gli atomi a una temperatura abbastanza vicini allo zero assoluto (0 K), sono raggruppati o "condensani", comportandosi come se fossero uno.
Pertanto, il rubido era il protagonista di questo trionfo nel campo della fisica, ed era Eric Cornell, Carl Wieman e Wolfgang Ketterle che hanno ricevuto il premio Nobel nel 2001 grazie a questo lavoro.
Diagnosi del tumore
Il radioisotopo sintetico 82RB decade emettendo positroni, che viene utilizzato per accumulare tessuti ricchi di potassio; Come quelli che si trovano nel cervello o nel cuore. Viene quindi utilizzato per analizzare la funzionalità del cuore e la presenza di possibili tumori nel cervello attraverso la tomografia a emissione di positroni.
Componente
Gli ioni di rubidio hanno trovato spazio in diversi tipi di materiali o miscele. Ad esempio, sono state realizzate le loro leghe con oro, cesio, mercurio, sodio e potassio. È stato aggiunto al vetro e alla ceramica probabilmente per aumentare il loro punto di fusione.
Nelle celle solari di Perovskitas sono stati aggiunti come componente importante. Allo stesso modo, il suo possibile utilizzo è stato studiato come generatore termoelettrico, materiale di trasmissione di calore nello spazio, combustibile nei motori a propulsione ionica, terreno elettrolitico per batterie alcaline e magneteri atomici.
Orologi atomici
Con Rubidio e cessa, i famosi orologi atomici sono stati fabbricati, molto precisi, utilizzati ad esempio nei satelliti GPS con cui i proprietari dei loro smartphone possono conoscere la loro posizione mentre si muovono su una strada.
Riferimenti
- Bond Tom. (29 ottobre 2008). Rubidio. Recuperato da: Chemistryworld.com
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Rubidio. Recuperato da: in.Wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Rubidio. Database PubChem. CID = 5357696. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Chellan, p., & Sadler, P. J. (2015). Gli elementi della vita e delle medicine. Transazioni filosofiche. Serie A, matematica, fisica e ingegneria scienze, 373 (2037), 20140182. Doi: 10.1098/RSTA.2014.0182
- Maggio della Fondazione per l'educazione medica e la ricerca. (2019). Rubidium RB 82 (percorso endovenoso). Recuperato da: Mayoclinic.org
- Marques Miguel. (S.F.). Rubidio. Recuperato da: Nautilus.Fis.Uc.Pt
- James L. Tintura. (12 aprile 2019). Rubidio. Encyclopædia Britannica. Recuperato da: Britannica.com
- Dottore. Doug Stewart. (2019). Fatti di Rubidium Element. Chemicool. Recuperato da: Chemicool.com
- Michael Pilgaard. (10 maggio 2017). Reazioni chimiche di rubidio. Recuperato da: pilgaardelegs.com
- « Storia dell'esperimento di Tuskegee, motivi e critiche
- Storia della malacologia, pratiche, ricerca »

