Renio Discovery, proprietà, struttura, usi

- 2591
- 155
- Silvano Montanari
Lui Renio È un elemento metallico il cui simbolo chimico è re e si trova nel gruppo 7 della tavola periodica, due posizioni sotto il manganese. Condividi con questo e la proprietà di Technio di più numeri o stati di ossidazione, da +1 a +7. Inoltre, forma un anione chiamato Perrenata, detenuto4-, Analogo al permanganato, MNO4-.
Questo metallo è uno dei più rari e scarsi di natura, quindi il suo prezzo è alto. Viene estratto come sottoprodotto di molibdeno e mining di rame. Una delle proprietà più rilevanti di Renio è il suo elevato punto di fusione, appena superato dal carbonio e dal tungsteno e la sua grande densità, essendo il doppio di quello del piombo.
 Sfera di Renio Metal. Fonte: immagini ad alta risoluzione degli elementi chimici/cc di (https: // creativeCommons.Org/licenze/di/3.0)
Sfera di Renio Metal. Fonte: immagini ad alta risoluzione degli elementi chimici/cc di (https: // creativeCommons.Org/licenze/di/3.0) La sua scoperta ha sfumature controverse e sfortunate. Il nome di "Renio" deriva dalla parola latina "Rhenus", che significa Rin, il famoso fiume tedesco vicino al sito in cui i chimici tedeschi che hanno isolato e identificato questo nuovo elemento hanno funzionato.
Renio ha numerosi usi, tra cui il perfezionamento dell'ottano di benzina.
[TOC]
Scoperta
L'esistenza di due elementi pesanti con caratteristiche chimiche simili a quelle del manganese stavano già prevedendo dal 1869, attraverso la tavola periodica del chimico russo Dmitri Mendelev. Tuttavia, a quel punto non era noto quale dovrebbe essere il loro numero atomico; Ed fu qui nel 1913 quando fu introdotta la previsione del fisico inglese Henry Moseley.
Secondo Moseley, questi due elementi appartenenti al gruppo di manganese devono avere numeri atomici 43 e 75.
Un paio di anni prima, tuttavia, il chimico giapponese Masataka Ogawa aveva scoperto il presunto elemento 43 in un campione di Torianita minerale. Dopo aver annunciato i suoi risultati nel 1908, voleva battezzare questo elemento con il nome di "Niponio". Sfortunatamente, i chimici a quel tempo hanno mostrato che Ogawa non aveva scoperto l'elemento 43.
Può servirti: cicloalques: struttura chimica, proprietà, nomenclaturaE così, altri anni passarono quando nel 1925 tre chimici tedeschi: Walter Noddack, Ida Noddack e Otto Berg, trovarono elementi 75 in campioni di minerali Columbita, Gadolinite e Molybdenite. Questi gli hanno dato il nome di Renio, in onore del Rin Rin della Germania ("Rhenus", in latino).
L'errore di Masataka Ogawa era quello di avere una discesa offerta nell'identificazione dell'elemento: aveva scoperto Renio, non l'elemento 43, chiamato Tecnecio oggi.
Proprietà Renio
 Situazione di Renio nella tavola periodica. !Originale: Ahoteseiervector: Sushant Savla/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0)
Situazione di Renio nella tavola periodica. !Originale: Ahoteseiervector: Sushant Savla/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0) Aspetto fisico
Renio è di solito commercializzato sotto forma di polvere grigiastra. I suoi pezzi di metallo, solitamente gocce sferiche, sono grigio argento, che sono anche molto luminosi.
Massa molare
186.207 g/mol
Numero atomico
75
Punto di fusione
3186 ºC
Punto di ebollizione
5630 ºC
Densità
-A temperatura ambiente: 21,02 g/cm3
-Proprio al punto di fusione: 18,9 g/cm3
Renio è un metallo che è quasi due volte più denso dello stesso piombo. Pertanto, una sfera di Renio che pesa 1 grammo può essere equiparata a un cristallo di piombo robusto della stessa massa.
Elettronegatività
1.9 sulla scala Pauling
Energie di ionizzazione
Primo: 760 kJ/mol
Secondo: 1260 kJ/mol
Terzo: 2510 kJ/mol
Capacità termica molare
25,48 J/(mol · K)
Conduttività termica
48,0 W/(M · K)
Resistività elettrica
193 nω · m
Durezza MOHS
7
Isotopi
Gli atomi di Renio sono presentati in natura come due isotopi: 185Re, con un'abbondanza del 37,4%; E 187Re, con un'abbondanza del 62,6%. Renio è uno di quegli elementi il cui isotopo più abbondante è radioattivo; Tuttavia, il tempo di mezza vita di 187Re è molto grande (4.12 · 1010 anni), quindi è praticamente considerato stabile.
Può servirti: nichel: storia, proprietà, struttura, usi, rischiReattività
Metallic Renio è un materiale resistente all'ossidazione. Quando lo fa, il suo ossido, è2O7, È volatilizzato ad alte temperature e brucia con una fiamma verde giallastra. I pezzi di Renio resistono all'attacco di Hno3 concentrato; Ma caldo, si dissolve per generare acido renico e biossido di azoto, che colorano la soluzione: la soluzione:
Re + 7hno3 → Hreo4 + 7 n2 + 3h2O
La chimica di Renio è vasta, perché è in grado di formare composti con un ampio spettro di numeri di ossidazione, oltre a stabilire un legame quadrupolo tra due atomi di Renio (quattro retribuzioni covalenti).
Struttura elettronica e configurazione
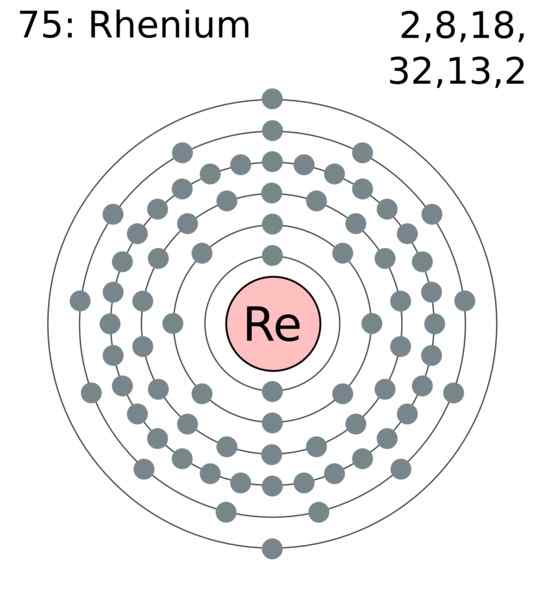 Strato di elettroni Renio. Autore: Utente: Gregrobson (Greg Robson). Wikimedia Commons
Strato di elettroni Renio. Autore: Utente: Gregrobson (Greg Robson). Wikimedia Commons Gli atomi di Renio sono raggruppati nei loro cristalli per causare una struttura esagonale compatta, HCP, che è caratterizzata da essere molto densa. Ciò è d'accordo con il fatto di essere un metallo di grande densità. Il collegamento metallico, il prodotto della sovrapposizione dei suoi orbitali esterni, mantiene gli atomi fortemente coesivi.
In questo collegamento metallico, partecipano agli elettroni di Valencia, che sono secondo la configurazione elettronica:
[Xe] 4f14 5 D5 6s2
In linea di principio, sono orbitali 5D e 6S che si sovrappongono per compattare gli atomi di RE nella struttura HCP. Si noti che i tuoi elettroni aggiungono un totale di 7, corrispondenti al numero del tuo gruppo nella tabella periodica.
Numeri di ossidazione
La configurazione elettronica di Renio una volta intraviene che il suo atomo è in grado di perdere fino a 7 elettroni, per diventare l'ipotetico catione7+. Quando viene assunta l'esistenza del re7+ In qualsiasi composto di Renio, ad esempio, nel re2O7 (Rif27+O72-), Si dice che abbia un numero di ossidazione di +7, re (vii).
Altri numeri di ossidazione positivi per Renio sono: +1 (re+), +2 (re2+), +3 (re3+), E così via a +7. Allo stesso modo, Renio può guadagnare elettroni diventando un anione. In questi casi, si dice che abbia un numero di ossidazione negativo: -3 (re3-), -2 (re2-) e -1 (re-).
Può servirti: idrolisi: cos'è e esempi di reazioniApplicazioni
Benzina
Renio, insieme al platino, viene utilizzato per creare catalizzatori che aumentano il grado di ottano di benzina, riducendo al contempo il contenuto di piombo. D'altra parte, i catalizzatori di Renio sono destinati a reazioni multiple di idrogenazione, questo a causa della loro resistenza all'avvelenamento dell'azoto, del fosforo e dello zolfo.
Superleazioni refrattarie
Renio è un prodotto in metallo refrattario del suo alto punto di fusione. Ecco perché le leghe di nichel vengono aggiunte per trasformarle refrattarie e resistenti a grandi pressioni e temperature. Queste superleazioni sono utilizzate principalmente per la progettazione di turbine e motori per le navi aerospaziali.
Filamenti di tungsteno
Renio può anche formare leghe con tungsteno, che migliora la sua duttilità e, quindi, facilita la produzione di filamenti. Questi filamenti Renio-tungsteno sono usati come fonti a raggi X e per la progettazione di termocoplati in grado di misurare le temperature fino a 2200 ° C.
Allo stesso modo, questi filamenti di Renio sono stati usati una volta per i lampi arcaici delle telecamere e attualmente per sofisticate lampade per equipaggiamento; come lo spettrofotometro di massa.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Sarah Pierce. (2020). Rhenio: uso, storia, fatti e isotopi. Studio. Recuperato da: studio.com
- Centro nazionale per le informazioni sulla biotecnologia. (2020). Renio. Database PubChem., CID = 23947. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Wikipedia. (2020). Renio. Recuperato da: in.Wikipedia.org
- Dottore. Doug Stewart. (2020). Fatti per elementi di renio. Recuperato da: Chemicool.com
- Eric scerri. (18 novembre 2008). Renio. Chimica nei suoi elementi. Recuperato da: Chemistryworld.com
- « Nessun elettroliti caratteristici ed esempi
- ALFA-COOTOGL Le proprietà, le funzioni e le applicazioni »

