Regola dell'ottetto

- 1223
- 232
- Kayla Serr
 Rappresentazione di una molecola di anidride carbonica che mostra la conformità alla regola degli ottetti
Rappresentazione di una molecola di anidride carbonica che mostra la conformità alla regola degli ottetti Qual è la regola dell'ottetto?
IL Regola dell'ottetto È una regola pratica che spiega la formazione del legame chimico degli elementi rappresentativi basati sulla configurazione elettronica del suo livello di valenza.
Secondo questa regola, gli atomi si combinano tra loro in modo tale che ogni atomo sia circondato da otto elettroni nel suo strato di valenza (da cui la parola ottetto).
Questa regola è stata pubblicata contemporaneamente in 1.916 Sia Gilbert Lewis che Walther Kossel. Riflette l'osservazione che i gas nobili sono molto stabili e tutto, ad eccezione dell'elio, sono caratterizzati dall'avere il loro strato di valenza con 8 elettroni.
La teoria stabilisce che gli atomi condividono o scambiano elettroni formando legami chimici, al fine di acquisire questa configurazione elettronica a livello intero.
La regola dell'ottetto e le strutture di Lewis
La regola dell'ottetto e le strutture di Lewis sono strettamente correlate. Questo perché la regola dell'ottetto è una delle basi per comprendere la formazione del legame chimico, quindi consente di prevedere nella maggior parte dei casi, la struttura di Lewis dei prodotti chimici.
In questo senso, uno dei passaggi essenziali per disegnare una struttura Lewis, dopo aver posizionato semplici collegamenti tra tutti gli atomi che formano la molecola, è distribuire gli elettroni di valenza rimanenti tra gli atomi più elettronegativi per completare i loro ottetti.
Nei casi in cui gli ottetti sono senza riempimento, si formano legami doppi o tripli, sempre alla ricerca della regola dell'ottetto per il maggior numero possibile di atomi. Quindi questa regola empirica è essenziale per la costruzione di strutture di Lewis.
Può servirti: Silver Yoduro (AGI): Struttura, Proprietà, Ottenimento, UsiEsempi di conformità con la regola dell'ottetto
La regola dell'ottetto viene principalmente applicata agli elementi rappresentativi, cioè a quelli dei blocchi S e P della tabella periodica. Questa regola è costantemente applicata a composti che contengono carbonio, azoto, ossigeno e alogeni e con alcune eccezioni agli altri elementi del blocco P. Tuttavia, la maggior parte dei metalli di transizione non rispetta.
Alcuni esempi di composti in cui la regola dell'ottetto è adempiuta per tutti gli atomi:
Anidride carbonica (CO2)
Come si può vedere nella struttura Lewis dell'anidride carbonica presentata di seguito, sia il carbonio centrale che entrambi gli atomi di ossigeno sono conformi alla regola dell'ottetto.
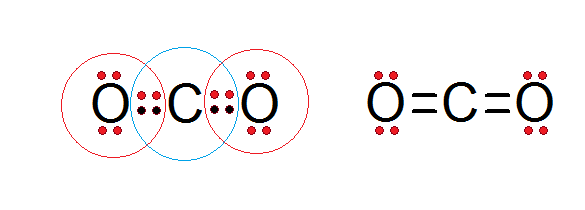
Il carbonio è circondato dai suoi 4 elettroni di valenza, più due elettroni di ciascun ossigeno, che contribuiscono a formare i doppi legami C = O, mentre ogni ossigeno è circondato da 6 elettroni più una coppia di carbonio.
Neopentano (c5H12)
Nella stragrande maggioranza dei composti organici, tutti gli atomi soddisfano la regola dell'ottetto (ad eccezione dell'idrogeno che è circondato da soli 2 elettroni). Ciò include alcani come Neopentano o 2.2-dimetilpropano:
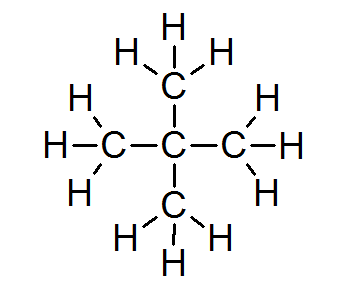
In questo caso si può anche vedere che ogni atomo di carbonio condivide i suoi quattro elettroni con 4 atomi vicini, ognuno dei quali fornisce uno dei suoi elettroni per formare i 4 semplici legami covalenti che tengono insieme.
Per questo motivo, ogni atomo di carbonio è circondato da 8 elettroni di valenza, rispettando la regola dell'ottetto.
Può servirti: energia di attivazioneMonossido di carbonio (CO)
Il monossido di carbonio è un altro composto molecolare in cui ossigeno e carbonio condividono gli elettroni che formano un legame covalente per soddisfare la regola dell'ottetto.
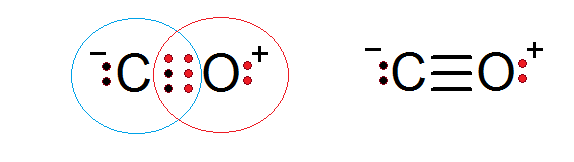
In questo caso, il carbonio fornisce due elettroni e ossigeno 4 per completare i 6 elettroni necessari per formare il triplo legame covalente che li unisce. Ognuno dei due atomi ha altri elettroni senza condividere che completano ogni ottetto.
Nitrato anione (no3-)
Anche nel caso degli ioni la regola dell'ottetto è soddisfatta. Lo ione nitrato ha un atomo di azoto centrale circondato da 3 atomi di ossigeno.
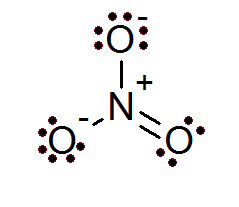
Come si può vedere in questo caso, tutti gli atomi hanno il loro ottetto completo, due dell'ossigeno hanno un carico formale negativo mentre l'azoto ha un carico formale positivo, che si traduce nel carico netto di -1 ioni di nitrato.
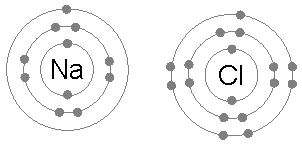
Cloruro di sodio (NaCl)
Lo scambio di elettroni per formare composti ionici è anche un esempio comune dell'applicazione della regola dell'ottetto.
Quando il cloruro di sodio è formato da cloro e sodio, inizia da due atomi che non rispettano la regola dell'ottetto, poiché il sodio su un elettrone e un cloro manca di completare il suo ottetto.
Quindi, il sodio dà il suo elettrone al cloro, lasciando il catione circondato da 8 elettroni e a sua volta completando l'ottetto al cloro formando lo ione del cloruro.
 Eccezioni alla regola dell'ottetto
Eccezioni alla regola dell'ottetto
Proprio come ci sono un gran numero di composti in cui tutti gli atomi soddisfano la regola dell'ottetto, ci sono anche più esempi di atomi che non ne sono conformi.
Può servirti: potenziale z: valori, gradi di coagulazione, determinazione, usiAlcuni sono circondati da meno di 8 elettroni, quindi lo sono specie di elettroni poveri, mentre altri sono circondati da più di otto elettroni, nel qual caso si dice che abbia un ottetto ampliato o viene chiamato Atomo ipervalente.
Esempi di specie di elettroni poveri
Bordean (BH3)
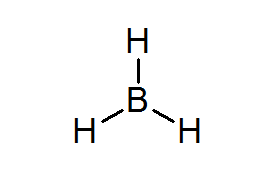
Questo composto è un tipico esempio di un cattivo tipo di elettroni. Né il boro né gli idrogeni circostanti hanno abbastanza elettroni per soddisfare la regola dell'ottetto nell'atomo centrale. Questo fa sì che il boro riceva un paio di elettroni da un altro atomo in un'altra molecola, trasformando il bordole in un acido da Lewis.
Triclurur in alluminio (ALCL3)
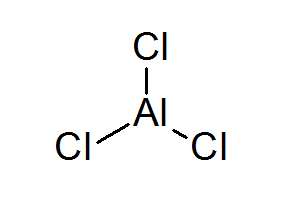
L'Alcl3 È un altro esempio di acido Lewis che deve il suo comportamento chimico a cui non incontra la regola dell'ottetto.
Esempi di specie ipervalenti
Sulphur Hexafluororo (SF6)
Un esempio tipico di un ottetto ampliato è l'SF6, che di solito è rappresentato come uno zolfo centrale con 6 semplici legami covalenti con atomi di fluoro. In questo caso, lo zolfo è circondato da 12 elettroni di valenza anziché 8, quindi viola la regola dell'ottetto.
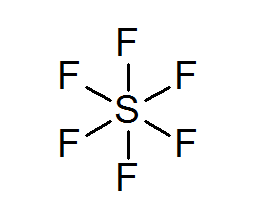
Nonostante ciò, sono stati proposti modelli in cui lo zolfo è effettivamente collegato a legami covalenti a 4 flue contemporaneamente, mentre con gli altri due, forma legami ionici. In tal caso, adempierebbe alla regola dell'ottetto.
Fosforo pentacloruro (PCL5)
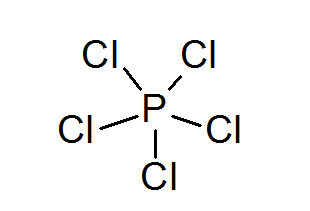
Come nel caso dello zolfo, il fosforo può anche formare composti con ottetti espansi, in questo caso circondato da 10 elettroni.

