Caratteristiche delle reazioni chimiche, parti, tipi, esempi

- 1408
- 265
- Cosetta Messina
IL reazioni chimiche Sono cambiamenti che la materia soffrono nell'ordinamento dei loro atomi e si svolgono quando due diverse sostanze o composti entrano in contatto. Nel processo cambia che possono essere percepiti immediatamente; come un aumento di temperatura, raffreddamento, formazione di gas, lampi o precipitazione di un solido.
Le reazioni chimiche più comuni spesso passano inosservate nella vita quotidiana; Migliaia di loro vengono eseguite nei nostri corpi. Altri, tuttavia, sono più visibili, perché possiamo eseguirli in cucina selezionando utensili e ingredienti corretti; Ad esempio, mescolare il bicarbonato con aceto, fondere lo zucchero in acqua o acidificare il succo di colord.
 La reazione di bicarbonato e aceto è un esempio di reazione chimica ricorrente in cucina. Fonte: Kate ter Har (https: // www.Flickr.com/foto/katerha/5703151566)
La reazione di bicarbonato e aceto è un esempio di reazione chimica ricorrente in cucina. Fonte: Kate ter Har (https: // www.Flickr.com/foto/katerha/5703151566) Nei laboratori, le reazioni chimiche diventano più solite e comuni; Tutti si verificano all'interno di becher (becher) o boccette Erlenmeyer. Se condividono in comune, nessuno è semplice, perché nascondono collisioni, pause di collegamento, meccanismi, formazione di collegamenti, energia e aspetti cinetici.
Ci sono reazioni chimiche così sorprendenti che i fan e gli scienziati, conoscendo la tossicologia dei reagenti e alcune misure di sicurezza, li riproducono su larga scale in affascinanti atti dimostrativi.
[TOC]
Concetto di reazione chimica
Le reazioni chimiche si svolgono quando c'è la rottura di un collegamento (ionico o covalente), in modo che un altro sia formato in posizione; Due atomi o un insieme di essi smettono di interagire fortemente per causare nuove molecole. Grazie a ciò, le proprietà chimiche di un composto, la sua reattività, stabilità, con ciò che reagisce può essere determinato.
Oltre ad essere responsabili le reazioni chimiche che la questione trasforma costantemente, senza i loro atomi, spiegano l'emergere dei composti come li conosciamo.
Per la rottura dei collegamenti, è necessaria l'energia e quando vengono formati i collegamenti, viene rilasciato. Se l'energia assorbita è maggiore di quella rilasciata, si dice che la reazione sia endotermica; Abbiamo un raffreddamento circostante. Mentre se il calore rilasciato è superiore all'assorbimento, allora sarà una reazione esotermica; L'ambiente circostante viene riscaldato.
Caratteristiche delle reazioni chimiche
Cinetica
Le molecole teoriche devono collaborare tra loro, portando con sé abbastanza energia cinetica per favorire la rottura di un legame. Se le collisioni sono lente o inefficienti, la reazione chimica viene influenzata cineticamente. Ciò può accadere dagli stati fisici delle sostanze o dalla geometria o dalla struttura della stessa.
Pertanto, in una reazione la questione viene trasformata assorbendo o rilasciando calore, mentre soffrono collisioni che favoriscono la formazione di prodotti; I componenti più importanti di qualsiasi reazione chimica.
Conservazione di massa
A causa della legge sulla conservazione della massa, la massa totale dell'insieme rimane costante dopo una reazione chimica. Pertanto, la somma delle singole masse di ciascuna sostanza è uguale alla massa del risultato ottenuto.
Cambiamenti fisici e/o cambiamenti di stato
Il verificarsi di una reazione chimica può essere accompagnato da un cambiamento di stato dei componenti; cioè una variazione nello stato solido, liquido o gassoso del materiale.
Tuttavia, non tutti i cambiamenti nello stato implicano una reazione chimica. Ad esempio: se l'acqua evapora a causa del calore, il vapore acqueo prodotto dopo questo cambio di stato rimane acqua.
Variazione del colore
Tra gli attributi fisici risultanti da una reazione chimica, il cambiamento nel colore dei reagenti rispetto al colore del prodotto finale si distingue.
Questo fenomeno è apprezzabile quando si osserva la reazione chimica dei metalli con ossigeno: quando un metallo è ossidato, cambia il suo colore caratteristico (oro o argento, a seconda dei casi), per diventare un tono arancione, noto come ruggine.
Rilascio di gas
Questa caratteristica si manifesta come un gorgogliamento o con l'emissione di odori particolari.
Generalmente, le bolle appaiono a seguito della presentazione di un liquido ad alte temperature, il che incoraggia un aumento dell'energia cinetica delle molecole che fanno parte della reazione.
Variazioni di temperatura
Nel caso in cui il calore sia un catalizzatore della reazione chimica, un cambiamento di temperatura sarà indotto nel prodotto finale. Pertanto, l'ingresso di calore e l'uscita nel processo possono anche essere una caratteristica delle reazioni chimiche.
Parti di una reazione chimica
Reagenti e prodotti
Una reazione chimica è rappresentata da un'equazione del tipo:
A + B → C + D
Dove A e B sono i reagenti, mentre C e D i prodotti. L'equazione ci dice che l'atomo o la molecola a, reagisce con B per causare prodotti C e D. Questa è una reazione irreversibile, poiché i reagenti non possono provenire dai prodotti. Invece, la reazione seguente è reversibile:
A + b c + d
È importante sottolineare che la massa dei reagenti (A+B) deve essere uguale alla massa dei prodotti (C+D). Altrimenti, l'impasto non sarebbe preservato. Allo stesso modo, il numero di atomi per un determinato elemento deve essere lo stesso prima e dopo la freccia.
Sopra la freccia indica alcune specifiche della reazione: la temperatura (Δ), l'incidenza della radiazione ultravioletta (HV) o il catalizzatore usato.
Può servirti: orologioReazione significa
Per quanto riguarda la vita e le reazioni che si verificano nei nostri corpi, il mezzo di reazione è acquoso (AC). Tuttavia, le reazioni chimiche possono essere sviluppate in qualsiasi mezzo liquido (etanolo, acido acetico glaciale, toluene, tetraidrofurano, ecc.) fintanto che i reagenti sono ben sciolti.
Contenitori o reattori
Le reazioni chimiche controllate si verificano in un contenitore, che si tratti di un semplice materiale di vetro o in un reattore in acciaio inossidabile.
Tipi di reazioni chimiche
I tipi di reazioni chimiche si basano su ciò che accade a livello molecolare; Quali collegamenti si rompono e come gli atomi finiscono per unirsi. Viene anche preso in considerazione se le specie guadagnano o perdono elettroni; anche quando ciò si verifica nella maggior parte delle reazioni chimiche.
Ecco i diversi tipi di reazioni chimiche esistenti.
- Riduzione dell'ossidazione (Rédox)
Ossidazione del rame
Nell'esempio della patina, avviene una reazione di ossidazione: il rame metallico perde elettroni in presenza di ossigeno per trasformarsi nel suo ossido corrispondente.
4cu (s) + o2(g) => cu2Voi)
L'ossido di rame (i) continua a ossidarsi per dare ossido di rame (II):
2cu2O (s) + o2 => 4cuo (s)
Questo tipo di reazione chimica in cui le specie aumentano o riducono il loro numero (o stato) di ossidazione, è noto come reazione di ossidazione e riduzione (Rédox).
Rame metallico con stato di ossidazione 0, prima perde un elettrone e poi il secondo (ossida), mentre l'ossigeno rimane (è ridotto):
Cu => cu+ + E-
Cu+ => Cu2+ + E-
O2 + 2e- => 2nd2-
Il guadagno o la perdita di elettroni può essere determinato calcolando i numeri di ossidazione per gli atomi nelle formule chimiche dei loro composti risultanti.
Per cu2Oppure, è noto che perché è un ossido, ha l'anione o2-, Quindi per mantenere i carichi neutralizzati ciascuno dei due atomi di rame deve avere un carico +1. Molto simile si verifica con CUO.
Rame quando ossidato acquisisce numeri di ossidazione positivi; e ossigeno, per essere ridotto, numeri di ossidazione negativa.
Ferro e cobalto
Di seguito sono riportati ulteriori esempi per le reazioni. Allo stesso modo, verrà fatto un breve commento e verranno specificati le modifiche ai numeri di ossidazione.
Fecl2 + Cocl3 => Fecl3 + Cocl2
Se vengono calcolati i numeri di ossidazione, si noterà che quelli del CL rimangono con un valore costante di -1; Non così, con quelli di fede e co.
A prima vista, il ferro si è ossidato mentre il cobalto è stato ridotto. Come sapere? Perché il ferro interagisce ora non con due CL- Ma con tre, essendo l'atomo di cloro più elettronegativo di ferro e cobalto. D'altra parte, il contrario accade a cobalto: passa dall'interazione con tre CL- a due di loro.
Se il ragionamento precedente non è chiaro, vengono scritte le equazioni chimiche del trasferimento netto di elettroni:
Fede2+ => Faith3+ + E-
Co3+ + E- => Co2+
Quindi fede2+ Si ossida, mentre il CO3+ è ridotto.
Iodio e manganese
6kmno4 + 5ki + 18HCl => 6MnCl2 + 5KIO3 + 6KCl+ 9h2O
La sostanza chimica di sopra può sembrare complicata, ma non lo è. Il cloro (CL-) non l'ossigeno (o2-) esperienza di guadagno o perdita dei loro elettroni. Iodio e manganese, sì.
Considerando solo composti con iodio e manganese che hai:
Ki => kio3 (Numero di ossidazione: da -1 a +5, perde sei elettroni)
Kmno4 => Mcl2 (Numero di ossidazione: da +7 a +2, vince cinque elettroni)
Iodio si ossida, mentre il manganese è ridotto. Come sapere senza calcolare? Perché lo iodio passa dall'essere con potassio per interagire con tre ossigeno (più elettronegativo); E il manganese, nel frattempo, perde interazioni con l'ossigeno per stare con il cloro (meno elettronegativo).
Il ki non può perdere sei elettroni se il kmno4 Vincere cinque; Ecco perché il numero di elettroni deve essere bilanciato nell'equazione:
5 (ki => kio3 + 6e-)
6 (KMNO4 + 5e- => Mcl2)
Che dà origine a un trasferimento netto di 30 elettroni.
Combustione
La combustione è un'ossidazione vigorosa ed energetica in cui vengono rilasciati luce e calore. Generalmente, in questo tipo di reazione chimica, l'ossigeno partecipa come un agente ossidante o combinaizzante; Mentre l'agente riducente è il carburante, che brucia alla fine del conto.
Dove ci sono ceneri, c'era una combustione. Questi sono composti da ossidi di carbone e metallo; Sebbene la sua composizione dipenda logicamente da cosa fosse il carburante. Di seguito sono riportati alcuni esempi:
C (s) + o2(g) => co2(G)
2co (g) + o2(g) => 2co2(G)
C3H8(g) + 5o2(g) => 3co2(g) + 4h2O (g)
Ognuna di queste equazioni corrisponde a combustioni complete; Cioè, tutto il carburante reagisce con un eccesso di ossigeno per garantire la sua completa trasformazione.
Va anche notato che il CO2 e h2Oppure sono prodotti gassosi a maggioranza quando i corpi gassati bruciano (come legno, idrocarburi e tessuti animali). È inevitabile che si formi un po 'di carbone alotropico, a causa di un'insufficienza di ossigeno, nonché a gas meno ossigenato come CO e non.
- Sintesi
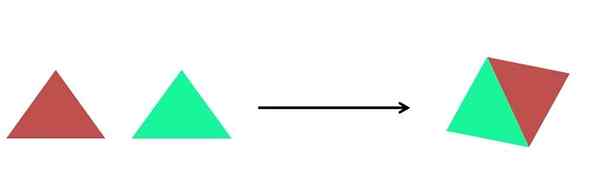
 Rappresentazione grafica di una reazione di sintesi. Fonte: Gabriel Bolívar.
Rappresentazione grafica di una reazione di sintesi. Fonte: Gabriel Bolívar. Nell'immagine superiore viene mostrata una rappresentazione molto semplice. Ogni triangolo è un composto o un atomo, che si unisce per formare un singolo composto; Due triangoli formano un parallelogramma. Le masse aumentano e le proprietà fisiche e chimiche del prodotto sono spesso molto diverse da quelle dei loro reagenti.
Può servirti: entalpyAd esempio, la combustione dell'idrogeno (che è anche una reazione di Rédox) produce ossido di idrogeno o idruro di ossigeno; meglio noto come agua:
H2(g) + o2(g) => 2h2O (g)
Mescolando entrambi i gas, ad alta temperatura, brucia producendo acqua gassosa. Temperature raffreddate, vapori condensano per dare acqua liquida. Diversi autori considerano questa reazione di sintesi come una delle possibili alternative per sostituire i combustibili fossili nell'ottenere energia.
I collegamenti H-H e O = O sono rotti per formare due nuovi semplici collegamenti: H-O-H. L'acqua, come è ben noto, è una sostanza senza pari (al di là del senso romantico) e le sue proprietà differiscono molto dall'idrogeno gassoso e dall'ossigeno.
Composti ionici
La formazione di composti ionici dai suoi elementi è anche un esempio di una reazione di sintesi. Uno dei più semplici è la formazione di algenuri metallici dei gruppi 1 e 2. Ad esempio, la sintesi del bromuro di calcio:
Ca (s) + Br2(L) => cabr2(S)
Un'equazione generale per questo tipo di sintesi è:
M (s) + x2 => Mx2(S)
Coordinazione
Quando il composto formato coinvolge un atomo metallico all'interno della geometria elettronica, si dice che sia un complesso. Nei complessi, i metalli rimangono uniti al ligando da legami covalenti deboli e sono formati da reazioni di coordinamento.
Ad esempio, hai il complesso [CR (NH3)6"3+. Questo si forma quando Cr cation3+ è in presenza di molecole di ammoniaca, NH3, che fungono da ligandi cromati:
Cr3+ + 6nh3 => [CR (NH3)6"3+
Di seguito è riportato l'ottaedro di coordinamento risultante attorno al Chrome Metal Center:
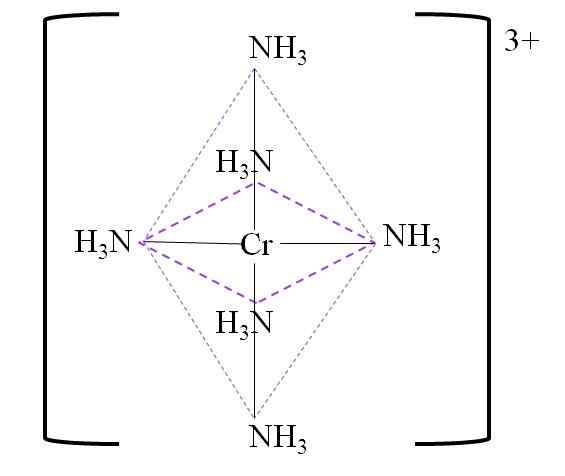 Coordinamento ottaedro per il complesso. Fonte: Gabriel Bolívar.
Coordinamento ottaedro per il complesso. Fonte: Gabriel Bolívar. Si noti che il carico di Chromium 3+ non è neutralizzato nel complesso. Il suo colore è viola, ed è per questo che l'ottaedro è rappresentato con detto colore.
Alcuni complessi sono più interessanti, come nel caso di alcuni enzimi che coordinano gli atomi di ferro, zinco e calcio.
- Decomposizione
La decomposizione diventa l'opposto della sintesi: un composto si rompe in uno, due o tre elementi o composti.
Ad esempio, ci sono le seguenti tre decomposizioni:
2Hgo (s) => 2Hg (L) + O2(G)
2h2O2(L) => 2h2O (l) + o2(G)
H2Co3(AC) => CO2(g) + H2O (l)
HGO è un solido rossastro che, dall'azione calda si rompe in mercurio metallico, liquido nero e ossigeno.
L'idrogeno perossido di idrogeno subisce una decomposizione, dando acqua liquida e ossigeno.
E acido carbonico, nel frattempo, si decompone in anidride carbonica e acqua liquida.
Una decomposizione più "secca" è quella subita da carbonati metallici:
Ladro3(s) => cao (s) + co2(G)
Vulcano di classe
 Mobili vulcano di dicromato di ammonio. Fonte: наталия [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Mobili vulcano di dicromato di ammonio. Fonte: наталия [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] Una reazione di decomposizione che è stata utilizzata nelle classi di chimica è la decomposizione termica del dicromato di ammonio, (NH4)2Cr2O7. Questo sale carcogenale arancione (quindi dovrebbe essere gestito con grande cura), brucia per rilasciare molto calore e produrre un solido verde, ossido cromico, CR2O3:
(NH4)2Cr2O7(s) => cr2O3(s) + 4h2O (g) + n2(G)
- Dislocamento
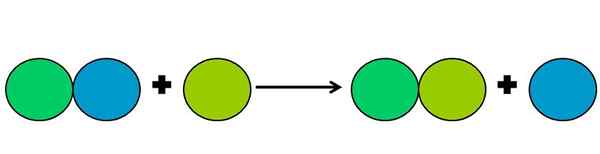 Rappresentazione grafica di una reazione di spostamento. Fonte: Gabriel Bolívar.
Rappresentazione grafica di una reazione di spostamento. Fonte: Gabriel Bolívar. Le reazioni di spostamento sono un tipo di reazione Rédox in cui un elemento sposta un altro in un composto. L'elemento spostato finisce per ridurre o guadagnare elettroni.
Per semplificare quanto sopra, l'immagine superiore viene mostrata. I cerchi rappresentano un elemento. Si osserva che il cerchio verde di Lima sposta quello blu, essendo all'esterno; Ma non solo, ma il cerchio blu è ridotto nel processo e quello di Green Lima viene ossidato.
Di idrogeno
Ad esempio, le seguenti equazioni chimiche per esporre quanto sopra:
2al (s) + 6HCl (AC) => ALCL3(AC) + 3H2(G)
Zr (s) + 2h2O (g) => zro2(s) + 2h2(G)
Zn (s) + h2SW4(AC) => Znso4(AC) + H2(G)
Qual è l'elemento sfollato per queste tre reazioni chimiche? Idrogeno, che è ridotto all'idrogeno molecolare, h2; passa da un numero di ossidazione da +1 a 0. Si noti che i metalli in alluminio, zirconio e zinco possono spostare gli idrogeni di acidi e acqua; Mentre rame, argento o oro, non possono.
Metalli e alogeni
Allo stesso modo, sono disponibili queste due reazioni di spostamento aggiuntive:
Zn (s) + cuo4(AC) => Cu (S) + Znso4(AC)
Cl2(g) + 2nai (ac) => 2Nacl (AC) + I2(S)
Nella prima reazione lo zinco sposta il rame in metallo meno attivo; Lo zinco si ossida mentre il rame è ridotto.
Nella seconda reazione, d'altra parte, il cloro, l'elemento più reattivo rispetto allo iodio, sposta quest'ultimo in sale di sodio. Qui si verifica all'indietro: l'elemento più reattivo è ridotto ossidando l'elemento spostato; Pertanto, il cloro si riduce all'ossidazione allo iodio.
- Formazione di gas
Nelle reazioni si potrebbe vedere che molti di loro hanno generato gas e, quindi, entrano anche questo tipo di reazione chimica. Allo stesso modo, le reazioni della sezione precedente, lo spostamento dell'idrogeno da parte di un metallo attivo, sono considerate reazioni di formazione del gas.
Può servirti: dodecil sodio solfato (SDS): struttura, proprietà, usiOltre a quelli già menzionati, i solfuri metallici, ad esempio, rilasciano idrogeno solforato (che odora le uova marce) quando viene aggiunto l'acido cloridrico:
N / a2S (s) + 2HCl (AC) => 2NACL (AC) + H2S (G)
- Metaesi o doppio spostamento
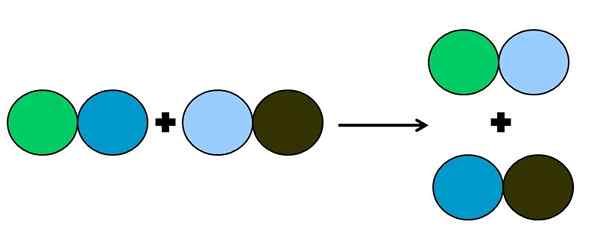 Rappresentazione grafica di una reazione a doppia spostamento. Fonte: Gabriel Bolívar.
Rappresentazione grafica di una reazione a doppia spostamento. Fonte: Gabriel Bolívar. Nella reazione di metatesi o doppio spostamento, ciò che accade è un cambiamento di coppie senza trasferimenti di elettroni; cioè, non è considerato una reazione Rédox. Come si può vedere nell'immagine superiore, il cerchio verde si interrompe il collegamento con quello del blu scuro per collegarsi al cerchio blu chiaro.
Precipitazione
Quando le interazioni di una delle coppie sono abbastanza forti da superare l'effetto di risoluzione del fluido, si ottiene un precipitato. Le seguenti equazioni chimiche rappresentano le reazioni di precipitazione:
Agno3(AC) + NaCl (AC) => AgCl (S) + Nano3(AC)
Cacl2(AC) + Na2Co3(AC) => Caco3(S) + 2NACL (AC)
Nella prima reazione il CL- sposta il no3- Per formare cloruro d'argento, AGCL, che è un precipitato bianco. E nella seconda reazione, il CO32- Sposta il cl- Per precipitare carbonato di calcio.
Acido base
Forse il più emblematico delle reazioni della metatanesi è quella dell'acido di base di neutralizzazione. Infine, due reazioni di acido base sono mostrate come esempi:
HCl (AC) + NaOH (AC) => NaCl (AC) + H2O (l)
2HCL (AC) + BA (OH)2(AC) => Bacl2(AC) + 2H2O (l)
OH- Si spostano al CL- Per formare sali di acqua e cloruro.
Esempi di reazioni chimiche
In basso e poi ci sarà menzione di alcune reazioni chimiche con le rispettive equazioni e commenti.
Dislocamento
Zn (s) + agno3(AC) → 2AG (S) + Zn (no3)2(AC)
Lo zinco sposta l'argento nel suo sale di nitrato: riduce AG+ Un Ag. Di conseguenza, l'argento in metallo inizia a precipitare nel mezzo, osservato su un microscopio che alberi senza argento. D'altra parte, il nitrato è combinato con ioni Zn2+ risultante per formare il nitrato di zinco.
Neutralizzazione
Ladro3(S) + 2HCL (AC) → CACL2(AC) + H2O (l) + co2(G)
L'acido cloridrico neutralizza il sale carbonato di calcio per produrre sale, cloruro di calcio, acqua e anidride carbonica. Il co2 bolle e viene rilevato in acqua. Questo bubb3.
NH3(G) + HCl (G) → NH4CL (S)
In questa seconda reazione, i vapori HCl neutralizzano l'ammoniaca gassosa. Il cloruro di ammonio salato, NH4Cl, è formato come un fumo biancastro (immagine inferiore), in quanto contiene particelle molto fini sospese nell'aria.
 Reazione di allenamento del cloruro di ammonio. Fonte: Adam Rędzikowski [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Reazione di allenamento del cloruro di ammonio. Fonte: Adam Rędzikowski [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] Doppio spostamento
Agno3(AC) + NaCl (AC) → AgCl (S) + Nano3(AC)
In una reazione a doppia spostamento c'è uno scambio di "coppie". L'argento cambia una coppia con sodio. Il risultato è che il nuovo sale, cloruro d'argento, AGCL, precipita come un solido latteo.
Rédox
 Nella reazione chimica che abbaia il calore del cane, il suono e la luce blu vengono rilasciati. Fonte: Maxim Bilovitskiy via Wikipedia.
Nella reazione chimica che abbaia il calore del cane, il suono e la luce blu vengono rilasciati. Fonte: Maxim Bilovitskiy via Wikipedia. Ci sono innumerevoli reazioni Rédox. Uno dei più impressionanti è quello di Barkin Dog:
8 n2O (g) + 4 cs2(L) → s8(s) + 4 co2(g) + 8 n2(G)
L'energia rilasciata è così tanto quando si formano i tre prodotti stabili, che un flash bluastro (immagine superiore) e un clamoroso aumento della pressione causata dai gas (CO2 e n2).
E inoltre, tutto ciò è accompagnato da un suono molto forte simile all'abbaiare di un cane. Lo zolfo prodotto, s8, Coprire il giallo le pareti interne del tubo.
Quale specie è ridotta e quale viene ossidata? Come regola generale, gli elementi hanno il numero di ossidazione 0. Pertanto, lo zolfo e l'azoto nei prodotti devono essere le specie che hanno guadagnato o perso elettroni.
Lo zolfo ossidato (elettroni persi), poiché aveva il numero di ossidazione -2 nel CS2 (C4+S22-)
S2- → s0 + 2e-
Mentre l'azoto era ridotto (elettroni vinti), perché aveva il numero di ossidazione +1 in n2O (n2+O2-)
2n+ + 2e → n0
Esercizi di reazioni chimiche risolte
- Esercizio 1
Ciò che il sale precipita nella prossima reazione in mezzo acquoso?
N / a2S (AC) + FESO4(AC) →?
Come regola generale, tutti i solfuri, ad eccezione di formati con metalli alcalini e di ammonio, precipitano in mezzo acquoso. Si verifica un doppio spostamento: il ferro si lega al solfuro e al sodio con solfato:
N / a2S (AC) + FESO4(AC) → Fes (S) + Na2SW4(AC)
- Esercizio 2
Quali prodotti otterremo dalla seguente reazione?
Francobollo3)2 + Ca (Oh)2 →?
L'idrossido di calcio non è molto solubile in acqua; Ma l'aggiunta di nitrato di rame aiuta a solubilirlo perché reagisce per formare il suo idrossido corrispondente:
Francobollo3)2(AC) + Ca (OH)2(AC) → Cu (OH)2(s) + Ca (no3)2(AC)
Il cu (oh)2 È riconosciuto istantaneamente per essere un precipitato blu.
- Esercizio 3
Quale sale si verificherà nella prossima reazione di neutralizzazione?
Al (Oh)3(s) + 3HCL (AC) → ¿¿?
L'idrossido di alluminio si comporta come una base che reagisce con acido cloridrico. In una reazione della neutralizzazione della base acida (dall'acqua di lowry di Brnsted) si forma sempre, quindi l'altro prodotto deve essere cloruro di alluminio, Alcl3:
Al (Oh)3(s) + 3HCL (AC) → Alll3(AC) + 3H2O
Questa volta l'ALCL3 Non fa precipitare perché è un sale (in una certa misura) solubile in acqua.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Ana Zita. (18 novembre 2019). Reazioni chimiche. Recuperato da: Todamateria.com
- Kashyap Vyas. (23 gennaio 2018). 19 Reazioni chimiche fresche che provano la scienza sta falsando. Recuperato da: ingegneria interessante.com
- Bellissimachimica.Net (s.F.). Reazione. Recuperato da: bellissimochemistry.netto
- Wikipedia. (2019). Reazione chimica. Recuperato da: in.Wikipedia.org

