Tipi e funzioni di proteolisi
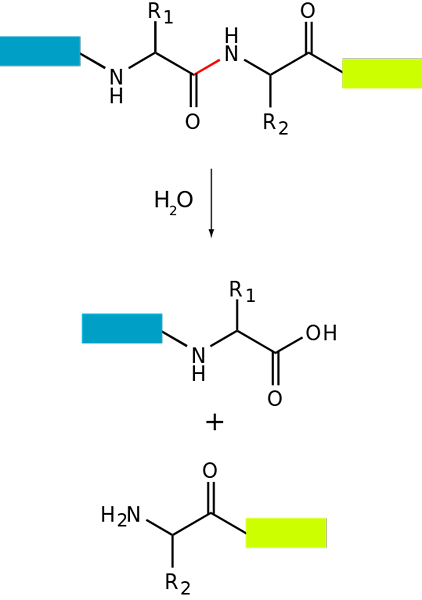
- 3007
- 553
- Dante Morelli
IL Proteolisi La degradazione della proteina O è un processo attraverso il quale una proteina cellulare può essere completamente degradata (anche i loro aminoacidi costituenti) o parzialmente (producendo peptidi). Cioè, consiste nell'idrolisi di uno o più collegamenti peptidici che tengono insieme i loro aminoacidi.
Questo processo può verificarsi grazie alla partecipazione di altre proteine con attività enzimatica, i cui siti attivi si verifica l'idrolisi dei collegamenti. Può anche verificarsi con "metodi" non enzimatici, come per azione di calore o sostanze con pH estremo (molto acido o molto semplice).
 Schema di proteolisi di base di una proteina (fonte: Fdardel [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons)
Schema di proteolisi di base di una proteina (fonte: Fdardel [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons) La degradazione delle proteine si verifica sia nei batteri, negli animali e nelle piante, ma è particolarmente comune negli animali, specialmente a livello di sistema digestivo, poiché dipende dalla digestione e dall'assorbimento intestinale delle proteine ingerite con la dieta.
Inoltre, la proteolisi è della massima importanza per il mantenimento funzionale e la regolazione di più processi cellulari e ha anche a che fare con l'eliminazione delle proteine che hanno traduzione, piegatura, imballaggio, importazione, funzionamento, ecc.
È importante notare che si tratta di un processo irreversibile ed estremamente efficace che funziona anche nella "regolazione dei regolatori", poiché elimina non solo quelle proteine che hanno attività biologiche "dirette", ma anche quelle che regolano altre proteine o espressione dei geni corrispondenti.
[TOC]
Tipi di proteolisi
Le proteine interne di una cellula possono essere degradate in modo casuale o selettiva o, ciò che è uguale, controllato o no. A sua volta, come accennato in precedenza, questo processo può verificarsi attraverso enzimi speciali o a causa di condizioni ambientali definite come pH acido e/o alcalino.
Può servirti: tessuto di rivestimento epitelialeÈ importante ricordare che qualsiasi proteina correttamente tradotta, piegata o confezionata nasconde una o più sequenze di segnali di degradazione che sono "criptici" e che possono essere esposti quando la proteina è strutturalmente disturbata da temperatura, pH, pH, ecc.
Proteolisi dell'ubiquitinazione
L'ubiquitinazione (sistema ubiquitina-proteosoma) è un sistema attraverso il quale le proteine possono essere idrolizzate selettivamente dopo essere state specificamente contrassegnate per la degradazione, un processo che può verificarsi sia in citosol che nel nucleo cellulare.
Questo sistema ha la capacità di riconoscere e distruggere le proteine contrassegnate nel nucleo e nel citosol, nonché di degradare le proteine che non si piegano correttamente durante la sua traslocazione dal citosol al reticolo endoplasmatico.
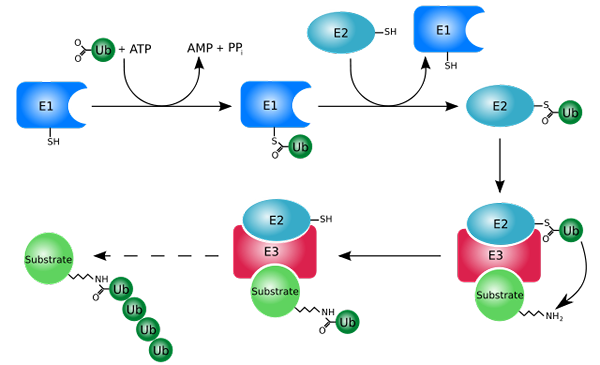 Processo di marcatura con ubiquitinas (ubiquitination) (fonte: rogerdodd [cc by-sa (http: // creativecommons.Org/licenze/by-sa/3.0/)] via Wikimedia Commons)
Processo di marcatura con ubiquitinas (ubiquitination) (fonte: rogerdodd [cc by-sa (http: // creativecommons.Org/licenze/by-sa/3.0/)] via Wikimedia Commons) Funziona principalmente aggiungendo o coniugando le proteine "bianche" a una piccola proteina o peptide di 76 rifiuti di aminoacidi, meglio noto come ubiquitina. Quelle proteine "marcate" per ubiquitinazione sono degradate in piccoli frammenti dal proteosoma 26S, una proteasi di diverse subunità.
Proteolisi autofagica
L'autofagia è anche considerata da alcuni autori come una forma di proteolisi, con la distinzione che ciò si verifica all'interno di un compartimento di membrana chiuso che è diretto verso i lisosomi (nelle cellule animali), dove le proteine contenute sono degradate dalle proteasi lisosomiali.
Proteolisi non enzimatica
La temperatura, il pH e persino la concentrazione di sali di un mezzo possono causare l'idrolisi dei legami peptidici che tengono uniti gli aminoacidi di diversi tipi di proteine, che si verificano per destabilizzazione e interruzione dei collegamenti.
Funzioni
La proteolisi ha molte funzioni negli organismi viventi. In particolare, ha a che fare con la sostituzione delle proteine.
Può servirti: ribosomi: caratteristiche, tipi, struttura, funzioniLe proteine hanno una mezza vita che varia da alcuni secondi a pochi mesi e i prodotti della loro degradazione, regolati o meno, mediati dagli enzimi o meno, sono generalmente riutilizzate per la sintesi di nuove proteine, che probabilmente svolgono funzioni diverse.
Questo è ciò che accade con le proteine che vengono consumate con cibo, che sono degradate nel tratto gastrointestinale dalle proteasi, tra cui Tripsin e Pepsina; così come con alcune proteine cellulari quando le cellule non hanno abbastanza cibo per sopravvivere.
I sistemi proteolitici intracellulari rilevano ed eliminano proteine "anormali" che sono potenzialmente tossiche per le cellule, poiché possono interagire con ligandi "fisiologicamente inappropriati", oltre a produrre aggregati che causano impedimenti meccanici e fisici per i normali processi cellulari.
L'accumulo di proteine anormali all'interno dell'interno cellulare, a causa di difetti nel sistema proteolitico interno o per altri motivi, è ciò che molti scienziati considerano una delle principali cause dell'invecchiamento negli esseri viventi multicellulari.
Nel sistema immunitario
La proteolisi parziale di molte proteine da fonti esogene o estranee come invasore i microrganismi, ad esempio, è un processo fondamentale per il sistema di risposta immunitaria, poiché i linfociti T riconoscono frammenti brevi, il prodotto della proteolisi (peptidi) Un set di proteine di superficie.
Questi peptidi possono provenire dal sistema di ubiquitinazione, processi autofagici o non eventi di proteolisi controllati.
Altre funzioni
Un'altra funzione di proteolisi limitata o parziale è la modifica delle proteine di nuova formazione, che funziona come una "preparazione" per le sue funzioni intra-estracellulari. Questo è vero, ad esempio, per alcuni ormoni e per le proteine coinvolte in diversi processi metabolici.
Può servirti: linfaopoyesis: caratteristiche, fasi, regolamentazioneLa morte cellulare programmata (apoptosi) dipende anche, in larga misura, dalla proteolisi "specifica del sito", limitata o parziale delle proteine intracellulari, che è mediata da una cascata di proteasi specifiche chiamate caspasi.
I sistemi di regolazione extracellulare dipendono anche dalla proteolisi specifica del sito e l'esempio più eccezionale è quello della coagulazione del sangue.
La proteolisi generale o completa svolge anche funzioni primarie per la degradazione selettiva di quelle proteine la cui concentrazione deve essere attentamente controllata a seconda dello stato fisiologico, metabolico o di sviluppo cellulare.
Nelle piante
Le piante usano anche i processi proteolitici per il controllo di molti dei loro aspetti fisiologici e di sviluppo. Funziona, ad esempio, nel mantenimento delle condizioni intracellulari e nei meccanismi di risposta a condizioni stressanti come siccità, salinità, temperatura, tra gli altri.
Così come negli animali, la proteolisi nella verdura. In questi organismi, la proteolisi mediante ubiquitinazione è una delle più importanti.
Riferimenti
- Alberts, b., Bray, d., Hopkin, k., Johnson, a. D., Lewis, J., Raff, m.,... e Walter, P. (2013). Biologia cellulare essenziale. Scienze della ghirlanda.
- Maurizi, m. R. (1992). Protesi e degraione proteica in Escherichia coli. Experientia, 48 (2), 178-201.
- Varshavsky, a. (2005). Degradazione della proteina regolata. Tendenze nelle scienze biochimiche, 30 (6), 283-286.
- Vierstra, R. D. (millenovecentonovantasei). Proteolisi nelle piante: meccanismi e funzione. Nel controllo post-trascrizionale dell'espressione genica nelle piante (PP. 275-302). Springer, Dordrecht.
- Lupo, d. H., & Messen, R. (2018). Meccanismi della proteolisi della regolazione cellulare, la grande sorpresa. Lettere FEBS, 592 (15), 2515-2524.
- « Paradise Ave Caratteristiche, habitat, proprietà, riproduzione, cura
- Caratteristiche del tripanosoma cruzi, ciclo di vita, malattie, sintomi »

