Caratteristiche di prolina, struttura, funzioni, cibo
- 4850
- 1516
- Rufo Longo
IL Prolina (Pro, P) appartiene ai 22 aminoacidi classificati come base. È un aminoacido non essenziale, poiché può essere sintetizzato dall'uomo e da altri animali da mammifero.
Nel 1900, lo scienziato tedesco Richard Willstatter fu il primo a estrarre e osservare la prolina. Tuttavia, fu Emili Fischer, nel 1901, a coniare il termine "prolina" in base all'anello pirrolidina dell'amminoacido; Questo ricercatore è anche riuscito a spiegare in dettaglio la sintesi della prolina dalla caseina del latte.
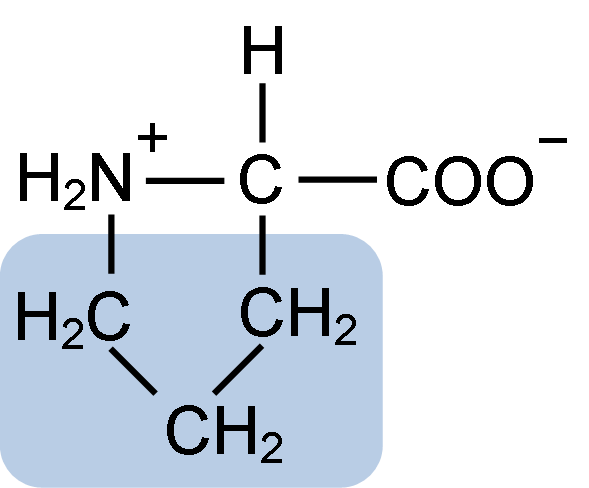
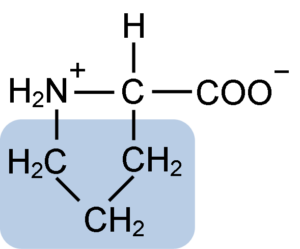 Struttura chimica dell'amminoacido di prolina (fonte: clavecina [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons)
Struttura chimica dell'amminoacido di prolina (fonte: clavecina [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons) In proteine come la caseina, Prolina ha una funzione indispensabile in "Turns" e ripiegamento strutturale. In questa proteina, la prolina è distribuita omogenea in tutta la struttura e si collega alla β caseina e alla proteina αS1; Inoltre, impedisce loop strutturali difettosi o pieghevole.
Nelle analisi biochimiche utilizzate attualmente per determinare l'esatta sequenza di aminoacidi che compongono le proteine, la prolina è uno degli aminoacidi di rilevamento più difficili, poiché il gruppo amminico secondario della prolina ha un comportamento diverso e non può essere facilmente rilevato.
Lo scorbuto è forse la malattia più nota correlata alla prolina. Ha a che fare con una carenza nell'assunzione di vitamina C, che colpisce direttamente l'idrossilazione della prolina nelle fibre di collagene, che provoca indebolimento sistemico a causa dell'instabilità delle fibre di collagene che si trovano in tutto il corpo.
[TOC]
Caratteristiche
Il gruppo amminico secondario basato sul carbonio α rende un po 'difficile l'attività di classificazione della prolina. Tuttavia, in alcuni testi questo è classificato accanto agli aminoacidi ramificati o con catene laterali alifatiche, poiché la catena laterale o la r r r della prolina è idrofobica o alifatica.
Una delle caratteristiche più importanti della prolina è che in nessun caso la forma di ponti idrogeno, il che lo rende ideale per strutturare le curve complesse e complesse nelle strutture terziarie delle proteine.
Proprio come tutti gli aminoacidi hanno due isoforme che dipendono dall'atomo di carbonio centrale, la prolina può essere trovata in natura come L-Prolina o come d-prolol. Tuttavia, la forma L-Prolina è la natura più abbondante ed è quella che fa parte delle strutture proteiche.
Nelle proteine in cui si trova, la prolina occupa spesso luoghi vicino alla superficie o alla piega o alla "giù" della catena del polipeptide, poiché la struttura rigida e chiusa della prolina rende difficile una forte interazione con altre interazioni aminoacidi.
Struttura
La prolina ha una struttura particolare tra aminoacidi di base, poiché presenta un gruppo di amino (NH2) secondario e non il gruppo amminico primario che è caratteristico di tutti gli aminoacidi.
Il gruppo R o la catena laterale della prolina è un anello di pirrolidina o tetraidropirrol. Questo gruppo è formato da un'ammina eterociclica (nessun doppio legame) di cinque atomi di carbonio, in cui ciascuno di questi è saturo di atomi di idrogeno.
La prolina ha la peculiarità che l'atomo di carbonio "centrale" è incluso nell'anello eterociclico della pirolidina, quindi gli unici atomi "liberi" o "eccezionali" sono il gruppo carbossilico (COOH) e l'atomo di idrogeno (H) dell'anello eterociclico di l'amminoacido.
Può servirti: dismutasi superossido: caratteristiche, struttura, funzioniLa formula molecolare della prolina è C5H9NO2 e il suo nome IUPAC è l'acido pirrolidin-2-carbossilico. Ha un peso molecolare approssimativo di 115,13 g/mol e la sua frequenza di apparizione nelle proteine è di circa il 7%.
Funzioni
Le fibre di collagene e tropocollagene sono le proteine più abbondanti nella maggior parte degli animali vertebrati. Questi costituiscono la pelle, i tendini, la matrice ossea e molti altri tessuti.
Le fibre di collagene sono costituite da molti trigger tripli polipeptidici che, a loro volta, sono composti da residui multipli di prolina e glicina nella sequenza di glicina-practolina-prolina/idrossiprololina (quest'ultimo è un derivato modificato della prolina).
Nella sua forma nativa, la prolina fa parte del Procollagen, questo è un precursore dei polipeptidi del collagene e alcune altre proteine del tessuto connettivo. L'enzima prolina idrossilasi.
Qual è la funzione principale della prolina nelle fibre di collagene?
L'idrossiprolina fornisce caratteristiche di resistenza al collagene, poiché questo derivato degli aminoacidi ha la capacità di formare un gran numero di ponti idrogeno tra le catene a tripla eltrazione che compongono la proteina.
Gli enzimi che catalizzano l'idrossilazione dei rifiuti di prolina richiedono la presenza di vitamina C (acido ascorbico) e, come menzionato sopra, lo scorbuto è dovuto all'indebolimento delle fibre di collagene a causa di fallimenti nell'idrossilazione dei rifiuti di prolina, che causano una riduzione di un calo in ponti idrogeno che sostengono le fibre di collagene.
Altre funzioni
La prolina è indispensabile per la formazione di pieghe e curve proteiche.
La sua struttura chiusa rende questo aminoacido difficile da "ospitare" le proteine interne, inoltre, poiché non può formare ponti idrogeno per "interagire" con altri rifiuti vicini, induce la formazione di "curve" o "giri" lungo la struttura delle proteine Dove si trova.
Tutte le proteine con un breve periodo di vita hanno almeno una regione con abbondante ripetuta prolina, glutammato, serina e treonina. Queste regioni vanno da 12 a 60 rifiuti e sono chiamate sequenze di parassiti.
Le proteine contenenti la sequenza dei parassiti sono contrassegnate dall'ubiquitinazione per la successiva degradazione nei proteosomi.
Biosintesi
Molti aminoacidi possono essere sintetizzati dagli intermediari di glicolisi, del pentosio fosfato o del ciclo dell'acido citrico (ciclo Krebs). Prolina e arginina si formano sulle brevi rotte del glutammato.
La via biosintetica praticamente comune per tutti gli organismi viventi inizia con la conversione di L-glutammato nel γ-L-glutamil-5-fosfato grazie all'azione dell'enzima glutamato-5-quinto (nei batteri) o dal γ-glutamil- Whinas (negli umani).
Questa reazione implica la fosforilazione dipendente dall'ATP, quindi, oltre al prodotto principale, viene generata una molecola ADP.
La reazione catalizzata dal glutammato 5-semia-limide deidrogenasi (nei batteri) o dal fosfato γ-glutamil reduttasi (nell'uomo) converte la presenza γ-L-glutamil-5-fosfato in l-glutamato-5-limid CO -FACTOR NADPH.
Può servirti: mezzo stuart: fondazione, preparazione e usiLa l-glutamato-5-semialdeide è reversibile e spontaneamente disidratato in (s) -1-1-pyrrool), nella cui reazione è anche necessaria una molecola di NADPH o NADH.
Degradazione
Prolina, arginina, glutammina e istidina sono costantemente degradati in α-zetoglutarato per entrare nel ciclo del ciclo di acido citrico o krebs. Nel caso particolare della prolina, questo viene prima ossidato dall'enzima di prolina ossidasi in pirrolina-5-carbossilato.
Nel primo passo, in cui si verifica l'ossidazione della prolina a pirrolina-5-carbossilato, i protoni distaccati sono accettati dall'e-Fad, riducendo a E-FADH2; Questo passaggio è esclusivo di prolina aminoacidi.
A causa di una reazione spontanea, la pirrolina-5-carbossilato viene trasformata in γ-semialdeide glutammato, che serve quindi come substrato per l'enzima glutammato γ-semi-limidico deidrogenasi. In questo passaggio emergono due protoni, uno di questi è accettato dalla NAD che è ridotta a NADH e l'altro è libero sotto forma di H+.
L'arginina, come la prolina, viene trasformata in γ-semialdeide glutammato, ma attraverso una via metabolica alternativa a cui partecipano due diversi enzimi.
L'enzima deidrogenasi γ-semialdeide trasforma il glutammato γ-semialdeide in l-glutammato. Successivamente, questo L-glutammato viene nuovamente ossidato da un enzima glutammato deidrogenasi, che forma infine l'α-zetoglutarato che sarà incorporato nel ciclo dell'acido citrico.
Nel passaggio di ossidazione del glutammato un protone (H+) viene rilasciato e un gruppo amminico (NH3+). Il protone riduce un gruppo NADP+ e una molecola NADPH.
Nonostante le numerose somiglianze esistenti tra le rotte di degradazione e biosintesi della prolina e dell'arginina, questi aminoacidi sono sintetizzati e degradati da percorsi totalmente opposti che usano enzimi diversi, diversi cofattori e che si verificano compartimenti intracellulari diversi.
Alimenti ricchi di valina
In generale, tutti gli alimenti con un alto contenuto di proteine hanno grandi quantità di prolina. Tra questi ci sono carne, latte, uova e altri. Tuttavia, quando il nostro corpo è in uno stato ottimale di salute e nutrizione, è in grado di sintetizzare la prolina endogena.
La prolina può essere trovata anche in molti legumi e noci e in cereali integrali come la farina d'avena, ad esempio. Altri cibi prolina sono crusca di grano, noci, mandorle, piselli, fagioli, tra gli altri.
Alcuni negozi naturistici di solito formulano compressi dagli aminoacidi L-Lisina e L-Prololina combinati per aiutare le persone con problemi articolari o per ritardare l'invecchiamento dei tessuti.
Tuttavia, non è stato dimostrato con certezza che l'ingestione di integratori alimentari di questi aminoacidi ha un effetto significativo sul ritardo della vecchiaia o di altre condizioni dell'avanzamento dell'età.
Vantaggi della tua assunzione
Le diete ricche di prolina sono generalmente prescritte per le persone che hanno malattie articolari come artrite, distorsioni, rottura del legamento, lussazioni, tendinite e altri, e questo è dovuto alla loro relazione con la sintesi di fibre di collagene presenti nei tessuti connettivi del corpo.
Può servirti: agar m.R.S: cosa è, fondazione, preparazione, usiMolte delle lozioni e compresse farmacologiche utilizzate nell'industria estetica sono arricchite con L-Prolina, poiché alcuni studi hanno dimostrato che questo aminoacido può in qualche modo aumentare la sintesi del collagene e, quindi, migliorare la consistenza della pelle, accelerare la guarigione delle ferite, lacerazioni, ulcere e ustioni.
Nell'industria alimentare ci sono proteine che hanno "peptidi bioattivi" che esercitano funzioni oltre le loro proprietà nutrizionali. Questi peptidi hanno generalmente da due a nove rifiuti di aminoacidi tra cui abbondano prolina, arginina e lisina.
Questi peptidi bioattivi possono avere attività antiipertensiva con un certo effetto oppioide; Possono agire come immunomodulatori stimolando la risposta immunitaria contro alcuni agenti patogeni e possono persino causare aumenti della vasoattività, il che migliora la circolazione di coloro che li consumano.
Disturbi da carenza
Il glutine è una proteina presente nei chicchi di grano che causa infiammazione dell'intestino. Le persone che soffrono di "intolleranza al glutine" sono conosciute come pazienti "celiaci" ed è noto che questa proteina è ricca di prolina e glutammina, la cui degradazione proteolitica è difficile per le persone con tale condizione.
Alcune malattie hanno a che fare con la cattiva piegatura di proteine importanti ed è molto comune per questi difetti avere a che fare con l'isomerizzazione Cis-trans di collegamenti Amida nei rifiuti di prolina, poiché, a differenza di altri collegamenti peptidici in cui l'isomero trans È molto favorito, nella prolina è svantaggiato.
Nei rifiuti di prolina si è osservato che esiste una tendenza significativa verso la formazione dell'isomero Cis prima dell'isomero trans Nelle ammidi adiacenti ai rifiuti prolina, che possono generare una conformazione "errata" delle proteine.
Disturbi metabolici
Come con altri aminoacidi essenziali e non essenziali, i principali disturbi patologici relativi alla prolina devono fare, di solito, con difetti sulle rotte di assimilazione di questo aminoacido.
L'iperprolinemia, ad esempio, è un tipico caso di carenza in uno degli enzimi che partecipano alla via di degradazione della prolina, in particolare nella rotta 1-pirolina-5.
Questa patologia viene generalmente diagnosticata da un alto contenuto di prolina nel plasma sanguigno e dalla presenza del metabolita 1-pirrololina-5-carbossilato nelle urine dei pazienti affetti colpiti.
I principali sintomi di questa malattia consistono in disturbi neurologici, malattie renali e perdita di capacità uditiva o sordità. Altri casi più gravi includono gravi ritardi mentali e marcate difficoltà psicomotorie.
Riferimenti
- Abu-Baker, s. (2015). Revisione della biochimica: concetti e connessioni
- Delauney, a. J., & Verma, D. P. S. (1993). Biosintesi di prolina e osmoregolazione nelle piante. The Plant Journal, 4 (2), 215-223.
- Elenco, b., Lerner, r. A., & Barbas, C. F. (2000). Reazioni aldol asimmetriche dirette catalizzate dalla prolina. Journal of the American Chemical Society, 122 (10), 2395-2396
- Nelson, d. L., Lechinger, a. L., & Cox, m. M. (2008). Principi di biochimica Lechinger. Macmillan.
- Plimmer, r. H. A. (1912). La costituzione chimica delle proteine (vol. 1). Longmans, verde.
- Szabado, l., & Savouré, a. (2010). Prolina: un aminoacido multifunzionale. Tendenze nella scienza delle piante, 15 (2), 89-97.

