Caratteristiche tiptofane, struttura, funzioni, benefici
- 4283
- 1203
- Cosetta Messina
Lui Triptofano (Trp, W) è un aminoacido classificato all'interno del gruppo di aminoacidi essenziali, poiché l'organismo umano non può sintetizzarlo e deve ottenerlo attraverso la dieta.
Alcuni alimenti come il latte e i loro derivati, carni, uova e alcuni cereali come quinoa e soia contengono aminoacidi essenziali e, quindi, sono una fonte importante di triptofano.
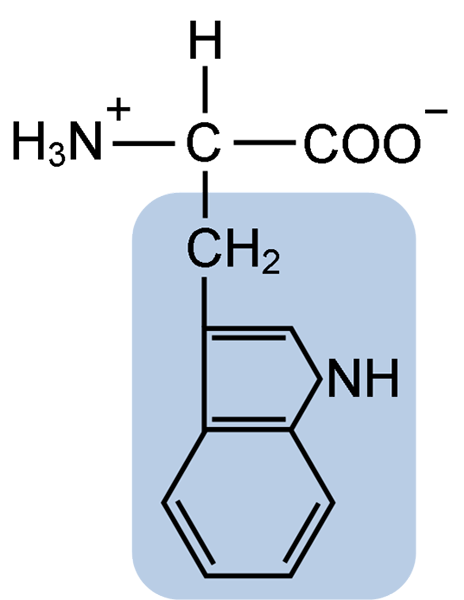
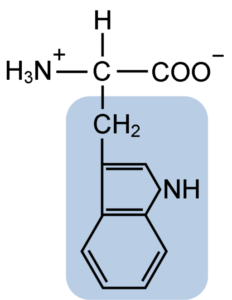 Struttura chimica dell'amminoacido tiptofano (fonte: clavecina [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons)
Struttura chimica dell'amminoacido tiptofano (fonte: clavecina [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons) In natura, sono noti oltre 300 aminoacidi diversi e solo 22 costituiscono le unità monomeriche delle proteine cellulari. Tra questi ultimi, 9 ci sono aminoacidi essenziali, incluso il triptofano, tuttavia, l'essenzialità di ciascuno differisce tra una specie e un'altra.
Il triptofano ha varie funzioni, tra cui la loro partecipazione alla sintesi proteica, nella sintesi della serotonina, che è un potente vasocostrittore e neurotrasmettitore, della melatonina e nella sintesi del co -fondatore NAD.
Nel regno vegetale, il triptofano è un precursore fondamentale dell'ormone vegetale noto come auxina (acido indolo-3-acetico). Può essere sintetizzato da alcuni batteri come E. coli Dal corismato, che è prodotto da alcuni derivati glicolitici come il fosfoenolpivato e l'eritrosa-4-fosfato.
La sua degradazione nei mammiferi si verifica nel fegato, dove viene utilizzato per la sintesi del coenzima Acetil.
Sono stati riportati vari studi con risultati controversi relativi all'uso del triptofano come integratore alimentare per il trattamento di alcune patologie come la depressione e alcuni disturbi del sonno, tra gli altri.
Ci sono alcune malattie legate ai difetti congeniti nel metabolismo degli aminoacidi. Nel caso del tiptofano, la malattia di Hartnup può essere nominata, a causa del triptofano -2,3 -monoxigenasi, una malattia ereditaria recessiva che è caratterizzata da ritardo mentale e alterazioni del tipo di pelagra di tipo pelle.
[TOC]
Caratteristiche
Insieme alla fenilalanina e alla tirosina, il triptofano si trova nel gruppo di aminoacidi aromatici e idrofobici.
Tuttavia, il triptofano è caratterizzato dall'essere un aminoacido leggermente idrofobico dalla sua catena laterale aromatica, con gruppi polari, attenua quell'idrofobicità.
Per avere anelli combinati, hanno un forte assorbimento della luce nella regione dello spettro vicino all'ultravioletta e questa caratteristica viene spesso utilizzata per l'analisi strutturale delle proteine.
Assorbe la luce ultravioletta (tra 250 e 290 nm) e, sebbene questo aminoacido non sia molto abbondante nella struttura della maggior parte delle proteine del corpo umano, la sua presenza rappresenta un contributo importante per la capacità di assorbimento della luce della luce nella regione della regione 280 nm di maggior parte delle proteine.
I requisiti quotidiani del triptofano differiscono con l'età. Nei bambini tra 4 e 6 mesi il requisito medio è di circa 17 mg per chilogrammo di peso al giorno; Nei bambini di età compresa tra 10 e 12 anni, è di 3,3 mg per chilogrammo di peso al giorno e negli adulti è di 3,5 mg per chilogrammo di peso al giorno.
Il triptofano viene assorbito dalla via intestinale ed è un aminoacido chetogenico e glicogeno allo stesso tempo.
Poiché si tratta di un precursore della serotonina, un importante neurotrasmettitore, il triptofano deve raggiungere il sistema nervoso centrale (SNC) e per questo deve attraversare la barriera cerebrale nel sangue, per il quale esiste un meccanismo di trasporto attivo specifico.
Può servirti: biggy agar: fondazione, preparazione e usiStruttura
Il triptofano ha una formula molecolare C11H12N2O2 e questo aminoacido essenziale ha una catena laterale aromatica.
Come tutti gli aminoacidi, il triptofano ha un atomo di carbonio α attaccato a un gruppo amminico (NH2), un atomo di idrogeno (H), un gruppo carbossilico (COOH) e una catena laterale (R) formata da una struttura eterociclica, il gruppo Indol.
Il suo nome chimico è acido 2-amino-3-propionico, ha una massa molecolare di 204,23 g/mol. La sua solubilità a 20 ° C è 1,06 g in 100 g di acqua e ha una densità di 1,34 g/cm3.
Funzioni
Nell'essere umano, il triptofano viene utilizzato per la sintesi proteica ed è indispensabile per la formazione di serotonina (5-idrossitriptamina) un potente vasocostrittore, stimolando la contrazione muscolare liscia (specialmente nell'intestino tenue) e una neurotrasmittente in grado di generare stimoli psichici, depressione da combattimento, combattimento e regolare l'ansia.
Il triptofano è un precursore nella sintesi della melatonina e, quindi, ha implicazioni nei cicli del sonno e della veglia.
Detto aminoacido è usato come precursore in uno dei tre modi per la formazione del cofattore NAD, un cofattore molto importante che partecipa a una varietà di reazioni enzimatiche relative agli eventi di riduzione dell'ossido.
Il triptofano e alcuni dei suoi precursori sono usati per la formazione di un ormone della vegetazione chiamato auxina (acido Indol-3-Active). Le auxine sono ormoni vegetali che regolano la crescita, lo sviluppo e molte altre funzioni fisiologiche delle piante.
Biosintesi
Negli organismi in grado di sintetizzarlo, lo scheletro di carbonio del triptofano deriva dal fosfoenolpiruvato e dall'eritrosa-4-fosfato. Questi, a loro volta, sono formati da un intermediario del ciclo di Krebs: ossalacetato.
Il fosfoenolpiruvato e l'erithro-4-fosfato sono usati per la sintesi del corisma su una via enzimatica. Il fosfoenolpivato (PEP) è un prodotto di glicolisi e erithro-4-fosfato della via del fosfato pentosio.
Come è la via della sintesi del corisma?
Il primo passo dei sintomi di Corismato è l'unione del PEP con l'eritrosa-4-fosfato per formare 2-Zo-3-Disoxxi-D-anabino-eptulosonato-7-fosfato (DAHP) (DAHP).
Questa reazione è catalizzata dall'enzima 2-ZO-3-DEXXI-D-anabino-eptulosonato-7-fosfato sintasi (DAHP syntasa), che è inibito dal coristato.
La seconda reazione implica la ciclazione del DAHP da parte della sintasi deidrochinata, un enzima che richiede il co -factor NAD, che è ridotto durante questa reazione; Di conseguenza, si verifica il 5-dishydroquinate.
La terza fase di questo percorso implica l'eliminazione di una molecola d'acqua di reazione 5-deidroquinata, catalizzata dall'enzima deidratasi deidrochinata, il cui prodotto finale corrisponde al 5-dishidro shikimato.
Il gruppo cheto di questa molecola è ridotto a un gruppo idrossilico e, di conseguenza, si forma Shikimato. L'enzima che catalizza questa reazione è la dipendente dipendente dal NADPH.
La quinta fase del percorso implica la formazione di shikimate a 5 fosfato e il consumo di una molecola ATP da parte di un enzima noto come chinasi shikimato, responsabile della fosforilazione di shikimate in posizione 5.
Successivamente, dallo shikimate a 5-fosfato e dall'azione del 3-enlapprivil shikimato-5-fosfato sintasi, viene generato 5-fosfato a 3-enlappiruvil shikimato. L'enzima di cui sopra promuove lo spostamento del gruppo fosforil.
Può servirti: perché è importante prendersi cura della biodiversità?La settima e ultima reazione è catalizzata dal corisma sintasi, che elimina il fosfato dal 5-fosfato shikimate a 3 enlappata e lo fa coristrare.
Nel fungo N. Crassa, Un singolo complesso enzimatico multifunzionale catalizza cinque delle sette reazioni di questa via e questo complesso sono aggiunti altri tre enzimi che finiscono per generare triptofano.
Sintesi triptofana nei batteri
In E. coli, La trasformazione del corisma di triptofano include una rotta enzimatica aggiuntiva:
Innanzitutto, l'enzima antranilato sintasi converte il corisma in antranilato. In questa reazione partecipa una molecola di glutammina, donata dal gruppo amminico che si lega all'anello indolo del triptofano e diventa glutammato.
Il secondo passo è catalizzato dall'antranilato di fosforribosil transferasi. In questa reazione una molecola di pirofosfato del 5-fosforribosil-1-pirofosfato (PRPP) (PRPP) si muove ricco di energia e si forma N- (5'-fosforibosil).
La terza reazione di questa via di sintesi del triptofano implica la partecipazione dell'enzima fosforibosil-isomerasi. Qui il n- (5'-phorribosil) -santhranilato.
Successivamente si forma il fosfato indolo-3-glicerolo, in una reazione catalizzata dalla simpatia indolo-3-glicerolo sintasi, in cui vengono rilasciati una molecola CO2 e H2O e l'1- (O-carbossyphenypheny) -1- deSoxyribulosa 5-fosfato 5-fosfato.
L'ultima reazione di questo percorso finisce per formare il triptofano quando il triptofano sintasi catalyz.
Degradazione
Nei mammiferi, il triptofano è degradato nel fegato in acetil-CoA su una via che coinvolge dodici passaggi enzimatici: otto per raggiungere α-zo-s-spoadipate e altri 4 per convertire l'α-Zo-dotadipato in acetil coenzima a.
L'ordine di degradazione fino a quando α-Cetoadipato è:
Tiptofano → N-Chinurenina formil → chinurenina → 3-idrossi chinurenine → 3-idrossi-antranilato → ε-semialdeide 2-amino-3-muconcycix molto → ε-semialdehido α-amino muconico amouzuz.
Gli enzimi che catalizzano rispettivamente queste reazioni:
Tiptofano 2-3-diossigenasi, formamidasi chinurenina, monoossigenasi NADPH-dipendente NADPH-dipendente.
Una volta generato α-cEToadipate, la decarbossilazione ossidativa si forma GLETERAL-COA. Questo, per ß-ossidazione, forma di glutaconil-CoA che perde un atomo di carbonio bicarbonato (HCO3-), vince una molecola d'acqua e termina come crotonil-CoA.
Crotonil-CoA, anche per ß-ossidazione, produce acetil-CoA. Detto acetil-CoA può seguire diversi modi, tra cui la gluconeogenesi, per formare il glucosio e il ciclo di Krebs, per formare ATP, se necessario, se necessario.
Tuttavia, questa molecola può anche essere diretta verso la formazione di corpi chetonici, che possono finalmente essere usati come fonte di energia.
Alimenti ricchi di triptofano
Le carni rosse in generale, il pollo e il pesce (in particolare i pesci blu come il salmone e il tonno) sono particolarmente ricchi di triptofano. Il latte e i suoi derivati, le uova, in particolare il tuorlo, sono anche alimenti con un sacco di triptofano.
Altri alimenti che fungono da fonte naturale di questo aminoacido sono:
- Noci come noci, mandorle, pistacchi e anacardo, tra gli altri.
- Cereali di riso.
- Cereali secchi come fagioli, lenticchie, ceci, soia, quinoa, ecc.
- Lievito di birra e fagioli freschi, banane e banane, ananas o ananá, avocado, prugne, crescione, broccoli, spinaci e cioccolato.
Può servirti: squalo sottomarino: storia, realtà o finzione?Vantaggi della tua assunzione
Il consumo di tiptofano è assolutamente necessario per sintetizzare tutte quelle proteine che lo includono nella sua struttura e attraverso le sue diverse funzioni consente di regolare i cicli dell'umore, del sonno e della vigila e un'ampia varietà di processi biochimici a cui NAD partecipa.
Oltre agli effetti noti sull'umore, la serotonina (derivata dal triptofano) interviene in molteplici funzioni cognitive relative all'apprendimento e alla memoria che, quindi, sono anche correlate al triptofano.
Esistono dati che mostrano la relazione tra umore, serotonina e asse gastrointestinale-cerebrale come sistema di influenze bidirezionali tra centri emotivi e cognitivi cerebrali e funzione periferica del tratto digestivo.
L'uso come integratore alimentare per il trattamento di alcuni disturbi, in particolare quelli legati al sistema nervoso centrale, è stato molto controverso perché il suo trasporto competitivo con aminoacidi neutri, molto più abbondante, rende difficile ottenere aumenti significativi e sostenuti del triptofano dopo la sua amministrazione orale.
Nonostante queste controversie, il suo uso è stato postulato in aggiunta a:
- Trattamento del dolore
- Disordini del sonno
- Trattamento della depressione
- Trattamento mania
- Riduzione dell'appetito
Disturbi da carenza
L'eliminazione centrale o la mancanza di triptofano è accompagnata da depressione, fallimenti nell'attenzione, diminuzione della memoria, del sonno e dei disturbi d'ansia.
Nei pazienti depressi e con tendenze suicidarie, sono state trovate alterazioni della concentrazione di sangue e liquido cerebrospinale. Inoltre, alcuni pazienti con anoressia nervosa mostrano bassi livelli sierici di triptofano.
Alcuni pazienti poliurici, che perdono la vitamina B6 e lo zinco, hanno spesso fobie e ansia e migliorano con integratori alimentari ricchi di triptofano.
La sindrome carcinoide è caratterizzata dalla presenza di tumori intestinali che causano diarrea, malattie vascolari e broncocostrizione ed è correlata al deficit di niacina e tripophane
Il pelagra è una condizione patologica che è accompagnata da diarrea, demenza, dermatite e può causare la morte, questo è anche trattato con integratori di niacina e triptofano.
La malattia di Hartnup deve fare, tra alcune cose, con un difetto nel metabolismo di diversi aminoacidi, incluso il triptofano.
Nel caso del deficit dell'enzima tiptofano -2,3-monoxigenasi, questa è una malattia ereditaria recessiva che è caratterizzata da ritardo mentale e alterazioni della pelle di tipo pelle.
Riferimenti
- Halvorsen, k., & Halvorsen, s. (1963). Malattia di Hartnup. Pediatria, 31(1), 29-38.
- Cappuccio, s. D., Bell, c. J., Argyropoulos, s. V., & Nutt, D. J. (2016). Il panico di Don. Una guida all'esaurimento del triptofano con provocazione di ansia specifica per disturbo. Journal of Psychopharmacology, 30(11), 1137-140.
- Jenkins, t. A., Nguyen, j. C., Polglaze, k. E., & Bertrand, P. P. (2016). Influenza del triptofano e della serotonina sull'umore e sulla cognizione con un possibile ruolo dell'asse intestinale. Nutrienti, 8(1), 56.
- Kaye, w. H., Barbarich, n. C., Putnam, k., Gendall, k. A., Fernstrom, J., Fernstrom, m.,... & Kishore, a. (2003). Effetti ansiolitici dell'esaurimento acuto del triptofano in anoressia nervosa. International Journal of Eating Disorders, 33(3), 257-267.
- Murray, r. K., Granner, d. K., Mayes, p., & Rodwell, V. (2009). Biochimica illustrata di Harper. 28 (P. 588). New York: McGraw-Hill.
- Nelson, d. L., Lechinger, a. L., & Cox, m. M. (2008). Principi di biochimica Lechinger. Macmillan.

