Processo isocorico
- 4859
- 658
- Rufo Longo
Cos'è un processo isocorico?
UN Processo isocorico È qualsiasi processo termodinamico in cui il volume rimane costante. Questi processi spesso ricevono anche il nome di isometrico o isovolumetrico. In generale, un processo termodinamico può verificarsi a pressione costante e viene quindi chiamato isobarico.
Quando si verifica a temperatura costante, in tal caso si dice che si tratti di un processo isotermico. Se non esiste uno scambio di calore tra il sistema e l'ambiente, allora si parla di adiabatico. D'altra parte, quando c'è un volume costante, il processo generato è chiamato isocorico.

Nel caso del processo isocorico, si può affermare che in questi processi il lavoro del volume di pressione è nullo, poiché ciò deriva dal moltiplicare la pressione per aumento del volume.
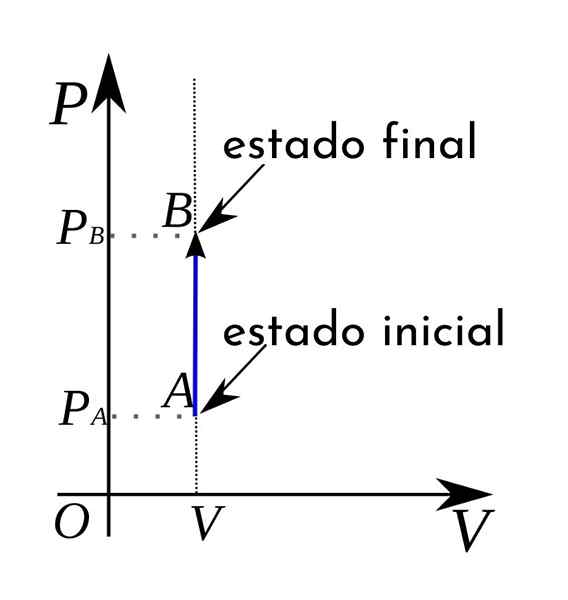
Inoltre, in un diagramma termodinamico del volume di pressione i processi isocorici sono rappresentati sotto forma di una linea retta verticale.
Formule e calcoli
Il primo principio della termodinamica
In termodinamica il lavoro viene calcolato dalla seguente espressione:
W = P ∙ ∆ V
In questa espressione è il lavoro misurato in joule, p la pressione misurata in Newton per metro quadrato e ∆ V è la variazione o l'aumento del volume misurato in misuratori cubi.
Allo stesso modo, il noto come il primo principio della termodinamica lo stabilisce:
∆ U = Q - W
In questa formula W è il lavoro svolto dal sistema o sul sistema, che è il calore ricevuto o emesso dal sistema e ∆ u È la variazione di energia interna del sistema. In questa occasione le tre magnitudini sono misurate in joule.
Poiché in un processo isocorico il lavoro è zero, si scopre che è soddisfatto:
Può servirti: Nettuno (pianeta)∆ U = QV (da quando, ∆ v = 0, e quindi w = 0)
Cioè, la variazione di energia interna del sistema è dovuta solo allo scambio di calore tra il sistema e l'ambiente. In questo caso, il calore trasferito si chiama calore a un volume costante.
 Capacità termica a volume costante
Capacità termica a volume costante
La capacità termica di un corpo o di un sistema deriva dalla divisione della quantità di energia sotto forma di calore trasferito a un corpo o un sistema in un determinato processo e la variazione di temperatura sperimentata dallo stesso.
Quando il processo viene effettuato a volume costante, si parla della capacità termica al volume costante ed è indicato da Cv (capacità di calore molare).
Sarà soddisfatto in quel caso:
Qv = N ∙ cv ∙ ∆t
In questa situazione, n è il numero di moli, cv È il suddetto capacità di capacità termica al volume costante e ∆T è l'aumento della temperatura sperimentato dal corpo o dal sistema.
Esempi giornalieri di processi isocorici
È facile immaginare un processo isocorico, è solo necessario pensare a un processo che si verifica a un volume costante; cioè, in cui il contenitore che contiene il materiale o il sistema di materiale non cambia volume.
Un esempio potrebbe essere il caso (ideale) bloccato in un contenitore chiuso il cui volume non può essere modificato con alcun mezzo che viene fornito calore. Supponiamo che il caso di un gas bloccato in una bottiglia.
Trasferire il calore in gas, come già spiegato, finirà per causare un aumento o un aumento della sua energia interna.
Il processo inverso sarebbe quello di un gas racchiuso in un contenitore il cui volume non può essere modificato. Se il gas si raffredda e dà calore all'ambiente, allora la pressione del gas e il valore dell'energia interna del gas diminuirebbero.
Può servirti: variabile discreta: caratteristiche ed esempiIl ciclo ideale Otto
Il ciclo Otto è un caso ideale del ciclo utilizzato dalle macchine a benzina. Tuttavia, il suo uso iniziale era nelle macchine che utilizzavano gas naturale o altri carburanti in uno stato gassoso.
In ogni caso, il ciclo ideale di Otto è un esempio interessante del processo isocorico. Si verifica quando si trova in un'auto a combustione interna, la combustione della benzina e della miscela d'aria avviene istantaneamente.
In tal caso, si verifica un aumento della temperatura e della pressione del gas all'interno del cilindro, rimanendo il volume costante.
Esempi pratici
Primo esempio
Dato un gas (ideale) bloccato in un cilindro fornito con un pistone, indicare se i seguenti casi sono esempi di processi isocorici.
- Un lavoro di 500 J sul gas è fatto.
In questo caso non sarebbe un processo isocorico perché per fare un lavoro sul gas è necessario comprimerlo e quindi modificare il suo volume.
- Il gas si espande orizzontalmente il pistone.
Ancora una volta non sarebbe un processo isocorico, poiché l'espansione del gas implica una variazione del suo volume.
- Il pistone del cilindro è fisso in modo che il gas non possa essere spostato e il gas viene raffreddato.
In questa occasione sarebbe un processo isocorico, poiché non ci sarebbe alcuna variazione di volume.
Secondo esempio
Determina la variazione dell'energia interna che sperimenterà un gas contenuto in un contenitore con un volume di 10 l sottoposti a 1 atm di pressione, se la sua temperatura sale da 34 ºC a 60 ° C in un processo isocorico, ha noto il suo specifico molare di calore calore calore calore calore calore Cv = 2.5 ·R (essendo R = 8.31 J/mol · K).
Può servirti: Graff Van Generator: Party, come funziona, applicazioniPoiché si tratta di un processo di volume costante, si verificherà solo variazioni di energia interna a causa del calore fornito al gas. Questo è determinato con la seguente formula:
Qv = N ∙ cv ∙ ∆t
Al fine di calcolare il calore fornito, è prima necessario calcolare le moli di gas contenute nel contenitore. Per questo, è necessario ricorrere all'equazione dei gas ideali:
P ∙ v = n ∙ r ∙ t
In questa equazione n è il numero di moli, r è una costante il cui valore è 8,31 j/mol · k, t è la temperatura, p è la pressione a cui il gas misurato in atmosfere e t è soggetto e t è la temperatura misurata a Kelvin.
È cancellato e ottenuto:
n = r ∙ t/ (p ∙ v) = 0, 39 talpe
Affinché:
∆ U = QV = N ∙ cv ∙ ∆t = 0,39 ∙ 2,5 ∙ 8,31 ∙ 26 = 210,65 j

