Struttura di perossido di idrogeno (H2O2), proprietà, usi, ottenendo

- 4274
- 193
- Benedetta Rinaldi
Lui perossido di idrogeno È un composto inorganico la cui formula chimica è h2O2. Tutti sono il perossido più semplice di questa famiglia di composti chimici. La sua formula strutturale è H-O-O-H, questo ponte ossigenato interno è caratteristico per tutti i perossidi.
Nel 1818, h2O2 È stato identificato da Louies Jacques Thénard, che ha preparato un composto chimico che ha chiesto allora Huzigenada. È un composto instabile, si decompone per esposizione alla luce, al calore e ad alcuni metalli.
 Formula chimica del perossido di idrogeno
Formula chimica del perossido di idrogeno È un composto molto utile che viene utilizzato nella disinfezione di ferite minori, sbiancamento dei capelli, trattamento dell'acqua, ecc. Sebbene possa avere azioni dannose per l'essere umano, si trova in tutte le cellule eucariotiche degli esseri viventi, dove svolge diverse funzioni benefiche.
Il perossido di idrogeno produce ossidazione di sostanze tossiche come fenoli, etanolo, formaldeide, ecc., Prodotti che sono eliminati dal fegato e dai reni. Inoltre, contribuisce alla distruzione dei batteri fagocitati da neutrofili e leucociti dei macrofagi.
[TOC]
Struttura
Molecola
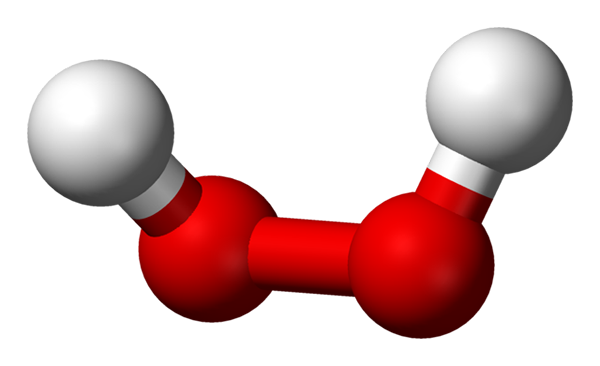 Molecola di perossido di idrogeno rappresentato con un modello di sfere e barre. Fonte: Benjah-BMM27 via Wikipedia.
Molecola di perossido di idrogeno rappresentato con un modello di sfere e barre. Fonte: Benjah-BMM27 via Wikipedia. Nell'immagine superiore si può vedere la struttura della molecola H2O2 (H-O-O-H), con le sfere rosse corrispondenti agli atomi di ossigeno e agli atomi di idrogeno bianco. Si noti che la molecola non è piatta e che né gli atomi H sono eclissi nello spazio (uno davanti all'altro).
È interessante notare che H2O2 È difficile ruotare il suo semplice collegamento centrale O-O, quindi le posizioni di queste H non possono essere scambiate; Uno non scenderà mentre l'altro sale.
Perché? Perché nei due atomi di ossigeno ci sono due coppie prive di elettroni, che danno un totale di otto elettroni molto vicini e che si respinge a vicenda per le loro cariche negative.
Rotazioni
Anche così, è probabile che il collegamento O-O ruoti a causa di interazioni con l'ambiente circostante.
Ad esempio, quando insieme ai due pollici, con le dita estese e le altre chiuse, come disegnare un tribunale, e quindi trasformare i pollici in modo tale che una delle dita si rivolge in avanti e l'altra all'indietro, ci sarà un rappresentazione approssimativa di H2O2.
Se un corpo gioca uno degli indici, i pollici ruoteranno in risposta a questa interazione; Tuttavia, torneranno immediatamente alla loro posizione originale a causa delle repulsioni elettroniche sopra menzionate. Queste rotazioni incorniciano gli aspetti dinamici di questa molecola.
Interazioni intermolecolari
Nello stato liquido la H2O2 riesce a stabilire ponti idrogeno (hooh-o2H2), altrimenti il suo alto punto di ebollizione (150 ºC) non sarebbe spiegato rispetto all'acqua.
Può servirti: solfato di calcio (CASE4): struttura chimica, proprietà, usiUna volta passa alla fase gassosa, le molecole M2O2 Presumibilmente non può più formare tali ponti, non solo alla massima distanza intermolecolare, ma anche gli atomi di idrogeno sarebbero i primi ad essere toccati in caso di collisioni (questo può essere visualizzato ricorrendo al modello di dita).
Nel frattempo, in fase solida l'angolo degli aerei che stabilisce l'H è di 90º (mettere le dita perpendicolari) dita). Ora i ponti idrogeno diventano ancora più importanti e le molecole H2O2 Sono ordinati in un cristallo di struttura tetragonale.
Proprietà
Sbotella con perossido di idrogeno. Nelle farmacie si ottiene con una concentrazione del 3% m/v. Fonte: Pixnio.
Nomi
-Perossido di idrogeno
-Diossidano
-Ossidanolo
-Acido peridoxico
-O-idrossilo
-Perossido di idrogeno
Massa molare
34.0147 g/mol
Aspetto fisico
Blu pallido (concentrato) o incolore. È leggermente più viscoso e denso dell'acqua. Viene distillato per sicurezza a basse temperature e una ridotta pressione, poiché si decompone riscaldando esplosivo.
Odore
Acuto o un odore simile all'ozono.
Gusto
Amaro
Densità
Solido 1,71 g/cm3
Le densità delle loro soluzioni acquose dipendono dalla loro concentrazione; Ad esempio, il 27 % ha una densità di 1,10 g/cm3, mentre il 50 %, 1,13 g/cm3
Punto di fusione
- 0,43 ºC
Punto di ebollizione
150,2 ºC. Questo valore è stato ottenuto mediante estrapolazione, poiché il perossido di idrogeno si decompone ad alte temperature.
Solubilità dell'acqua
Miscibile ≥ 100 mg/ml a 25 ° C
Solubilità
È solubile in etere e alcol, ma insolubile nell'etere dell'olio. Si decompone in acqua e ossigeno in molti solventi organici.
Coefficiente di partizione ottanolo/acqua
Log p = - 0,43
Pressione del vapore
5 mmHg a 30 ºC.
Costante di dissociazione
PKA = 11.72
ph
Le soluzioni di perossido di idrogeno sono leggermente acide. Ad esempio, uno a 35% ha un pH di 4,6; Ma quando si concentra al 90%, il pH diventa meno acido: 5.1.
Indice di rifrazione (nD)
1.4061
Sostanza vischiosa
1.245 cpoise a 20 ° C.
Capacità termica
1.267 J/G · K (gas)
2.619 J/G · K (liquido)
Calore di vaporizzazione
1.519 J/G · K
Stabilità
Stabile nelle condizioni raccomandate. L'aggiunta di acetanilide e sali di stagno lo stabilizza di più.
Corrosione
Corrosivo
Decomposizione
Si decompone per esposizione alla luce o in presenza di sostanze ossidanti e riducenti. È anche scomposto dal riscaldamento. Quando viene sequestrato, l'acqua e l'ossigeno vengono rilasciati e favoriti da un aumento del pH e della temperatura, nonché con la presenza dell'enzima di Catlase.
Può servirti: perossido di sodio (Na2o2): struttura, proprietà, usiTensione superficiale
80,4 Dins/cm a 20 ºC
Reattività
Il h2O2 Agisce come agente ossidante nelle soluzioni acide del ferro ferroso (fede2+) Ferro ferrico (F3+); ossidare anche ioni solfito (così32-) al solfato ione (SO42-).
Può anche fungere da agente riducente in presenza di soluzioni di base, riducendo l'ipoclorito di sodio (Naocl) e il permanganato di potassio (KMNO4) Con rilascio di ossigeno.
Applicazioni
Sbiancamento
Il perossido di idrogeno viene utilizzato nell'industria cartacea nella sbiancamento della polpa e della carta, che consuma la maggior parte della sua produzione annuale.
Disinfettante
Il perossido di idrogeno è un delicato antisettico per evitare piccole infezioni, graffi e ustioni della ferita. Viene anche usato come risciacquo della bocca e per alleviare l'irritazione della bocca lieve a causa della presenza di bocchini o della gengivite.
Viene anche utilizzato per disinfettare le superfici, l'interno dei frigoriferi, l'acqua e il combattimento della crescita batterica eccessiva nei sistemi idrici e le torri di raffreddamento. Il perossido di idrogeno rilascia radicali senza ossigeno, che decompongono gli inquinanti.
Detergente
Il perossido di idrogeno viene utilizzato nella produzione di detergenti sbiancanti dei vestiti, incluso il carbonato di sodio. Questo composto è un complesso di carbonato di sodio e perossido di idrogeno che viene sciolto nell'acqua si separa nei suoi componenti.
Applicazione cosmetica
Il perossido di idrogeno diluito viene utilizzato nella sbiancamento dei capelli, prima della colorazione. Viene anche usato per sbiancare i denti, come parte di una crema dentale fatta in casa.
Propellente
Il perossido di idrogeno viene usato come componente monoporpellante o ossidante di un razzo bipropoo. Si rompe rilasciando ossigeno e acqua, una caratteristica che ha permesso il suo uso come propellente.
Una cellula di reazione viene pompata con la presenza di un catalizzatore che accelera la decomposizione. Durante questo, il vapore acqueo viene prodotto ad alta temperatura.
Quando il vapore viene espulso attraverso un divario produce un impulso. Il sottomarino V-80 costruito nel 1940, usato nelle turbine di ossigeno generate dal perossido di idrogeno; Chiamato sistema di turbine Walter.
Ottenimento
Inizialmente il perossido di idrogeno è stato ottenuto industrialmente mediante idrolisi del persolfato di ammonio, [(NH4)2S2O8] o l'elettrolisi del bisolfato di ammonio, NH4HSO4.
Il perossido di idrogeno si ottiene industrialmente attraverso l'uso di antraquinone. Il processo viene eseguito in quattro fasi: idrogenazione, filtrazione, ossidazione, estrazione e purificazione.
Può servirti: fluoruro di magnesio: struttura, proprietà, sintesi, usiIdrogenazione
Alquilantroquinona viene idrogenata passando per il gas idrogeno attraverso un idrogenatore caricato con allumina e una piccola quantità di catalizzatore (paladio). La temperatura viene mantenuta a 45 ºC con agitazione permanente.
L'alchindrochinone viene convertito in alquiloantraidrochinona e il tetraidroalquilantraidrochinone, selezionando quest'ultimo per la sua massima comodità per le seguenti procedure.
Filtrazione
La soluzione contenuta.
Ossidazione
La soluzione filtrata si ossida passando l'aria attraverso di essa, formando perossido di idrogeno a bassa purezza.
Estrazione e purificazione
La soluzione con perossido di idrogeno attraversa una colonna di estrazione liquido-liquido. L'acqua scorre attraverso la colonna, mentre la soluzione con perossido di idrogeno viene pompata da essa.
L'acqua raggiunge il fondo dell'estrattore con una concentrazione di perossido di idrogeno tra il 25 e il 35 % P/P. Quindi, viene purificato mediante distillazione del vuoto, a una concentrazione di perossido di idrogeno al 30 %. Finalmente stabilizzato e immagazzinato.
Rischi
 Brucia di perossido di idrogeno. Fonte: Bobjgalindo [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Brucia di perossido di idrogeno. Fonte: Bobjgalindo [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] Il perossido di idrogeno è un agente corrosivo, quindi il contatto cutaneo produce una grave irritazione, oltre allo sbiancamento temporaneo (immagine superiore). Può anche produrre danni agli occhi, prurito, salpt, arrossamento e ampoule.
La sua inalazione produce irritazione nel naso, nella gola e nei polmoni. Nel frattempo, un'esposizione ripetuta può causare bronchite, tosse, flemma e accorciamento della respirazione. E come se non bastasse, genera anche mal di testa, vahid, nausea e vomito.
Una grave esposizione al perossido di idrogeno può produrre un accumulo di liquidi nei polmoni, che è noto come edema polmonare: condizioni gravi che richiedono una pronta attenzione medica.
La Safety and Health Administration (OSHA) ha stabilito il massimo consentito per il perossido di idrogeno di 1 ppm in un ambiente di lavoro in un giorno di 8 ore. Tuttavia, poiché è un composto mutageno, l'esposizione al minimo deve essere ridotta.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Perossido di idrogeno. Recuperato da: in.Wikipedia.org
- William R. Busing e Henri a. Levy. (2004). Struttura cristallina e molecolare del perossido di idrogeno: uno studio di diffrazione di neutroni. doi.org/10.1063/1.1696379
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Perossido di idrogeno. Database PubChem. CID = 784. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- I redattori di Enyclopedia Britannica. (27 novembre 2018). Perossido di idrogeno. Encyclopædia Britannica. Recuperato da: Britannica.com
- Dipartimento della salute del New Jersey. (2016). Perossido di idrogeno. [PDF]. Recuperato da: NJ.Gov
- Mathews, c. K., Van Holde, K. E., Ahern, k. G. (2002). Biochimica. Terza edizione. Editoriale di Pearson Addison Wesley
- MD Web. (2019). Perossido di idrogeno. Estratto da: WebMD.com
- « Storia della medicina azteca, Dio, piante, malattie
- Struttura di ossido di zinco (ZnO), proprietà, usi, rischi »

