Caratteristiche di ossihemoglobina, struttura e curva di giunzione
- 4585
- 1074
- Silvano Montanari
OXihemoglobin È il nome che l'emoglobina riceve quando si unisce all'ossigeno. L'emoglobina è una proteina che si trova all'interno dei globuli rossi e la cui funzione principale è trasportare ossigeno dai polmoni ai tessuti.
I primi esseri viventi erano unicellulari e vivevano in un'atmosfera liquida da cui erano nutriti e a cui eliminarono i loro rifiuti, così come alcuni degli organismi attualmente esistenti. In queste condizioni, questi processi sono raggiunti da semplici meccanismi di diffusione, poiché la parete cellulare è in contatto intimo con il mezzo che lo fornisce.
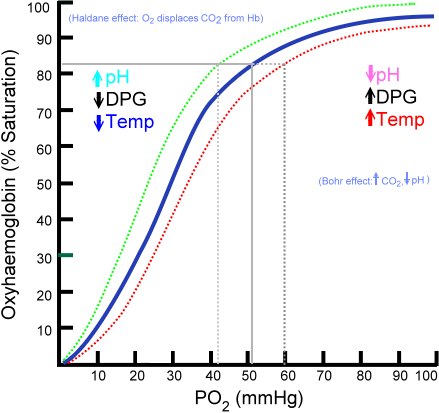
 Curva di dissociazione dell'ossihemoglobina (fonte: ratznium in inglese versioni di Wikipedialat sono state caricate da Aaronsharpe a in.Wikipedia. [Dominio pubblico] via Wikimedia Commons)
Curva di dissociazione dell'ossihemoglobina (fonte: ratznium in inglese versioni di Wikipedialat sono state caricate da Aaronsharpe a in.Wikipedia. [Dominio pubblico] via Wikimedia Commons) Lo sviluppo di organismi pluricellulari sempre più complessi implicava che le cellule interne fossero notevolmente allontanate dall'ambiente, quindi i meccanismi di diffusione quando la sola fonte di approvvigionamento non diventava insufficiente.
Pertanto, sono stati sviluppati sistemi specializzati per ottenere nutrienti e gas come il sistema digestivo e il sistema respiratorio, nonché meccanismi di trasporto per portare questi nutrienti e gas nella cellula: il sistema cardiovascolare.
Per produrre energia sotto forma di molecole ATP, le cellule necessitano di ossigeno. In considerazione del fatto che l'ATP non può essere immagazzinato, deve essere costantemente sintetizzato, il che significa una domanda permanente di ossigeno da parte delle cellule.
L'emoglobina è emersa, evolutivamente parlando, come trasportatore di gas che "risolve" il problema del trasporto di ossigeno dall'ambiente alla cellula.
[TOC]
Caratteristiche e struttura
Per parlare delle caratteristiche e della struttura dell'ossiemoglobina è necessario fare riferimento all'emoglobina, poiché l'ossiemoglobina non è altro che emoglobina di ossigeno. Pertanto, da ora in poi, saranno descritte le caratteristiche articolari della molecola in presenza o meno del gas in questione.
A cosa serve l'emoglobina?
L'emoglobina è necessaria per trasportare ossigeno sui tessuti nella quantità e velocità che meritano, in considerazione del fatto che l'ossigeno ha così poca solubilità del sangue che il suo trasporto di diffusione sarebbe insufficiente per soddisfare le esigenze dei tessuti.
Può servirti: prove dell'evoluzione degli esseri viventiCom'è una molecola di emoglobina?
L'emoglobina è una proteina tetramerica (che ha quattro subunità), ha una forma sferica e una massa molecolare di 64 kDa.
Le sue quattro subunità costituiscono un'unica unità funzionale, in cui ognuna influenza reciproca l'altra. Ogni subunità è composta da una catena polipeptidica, globina e un gruppo protesico, il gruppo Hemo o "Hem", che funge da cofattore e non è formato da aminoacidi; cioè, non è la natura proteica.
Globin è in due modi: Alpha Globin e Beta Globin. Il tetramer di emoglobina è costituito da una coppia di catene alfa globiniche (141 aminoacidi) e un paio di catene beta globiniche (146 aminoacidi).
Ciascuna delle quattro catene polipeptidiche è collegata a un gruppo Hemo, che ha un atomo di ferro in stato ferroso (Fe2+) al centro.
Com'è il gruppo Hemo?
Il gruppo Hemo è un anello di porfirina che è formato da quattro anelli pirrolici (composti eterociclici aromatici con la formula C4H5N) uniti da ponti metilici. Il ferro in stato ferroso trovato al centro è soggetto alla struttura attraverso collegamenti azoti coordinati.
Ogni gruppo Hemo è in grado di unirsi a una molecola di ossigeno, quindi ogni molecola di emoglobina può unire solo 4 molecole di gas.
Il corpo umano contiene circa 2,5 x 1013 eritrociti, che sono le cellule del sangue che producono e trasportano emoglobina. Ogni eritrocita ha circa 280 milioni di molecole di emoglobina e può quindi trasportare oltre 1000 milioni di molecole di ossigeno.
Può servirti: processo di ominizzazione: caratteristiche e fasiCome viene formata l'ossiemoglobina?
L'ossiemoglobina si forma dopo l'unione di un atomo di ossigeno per ogni atomo di ferro ferroso che trova in ciascun gruppo di emo della molecola di emoglobina.
Il termine oxemoglobina si riferisce quindi a un'emoglobina ossigenata e non chimicamente ossidata, poiché non perde un elettrone quando combinato con ossigeno e ferro rimane nello stato ferroso.
L'ossigenazione produce un cambiamento nella struttura quaternaria della molecola, cioè un cambiamento nella conformazione che può essere trasmesso dalle catene di globina all'emo e al viceversa gruppo.
Qual è la massima quantità di ossigeno che può caricare emoglobina?
L'emoglobina può, al massimo, unirsi a quattro molecole di ossigeno nella sua struttura. Se il volume molare dei gas ideali è 22.4 l/mol, un mol di emoglobina (64.500 g) si unirà a 89.6 litri di ossigeno (4 moli di O2 x 22.4 l/mol).
Quindi, ogni grammo di emoglobina deve unirsi a 1.39 ml di O2 saranno saturi al 100% (89.6L/64500G X (1000ml/L)).
In pratica, gli esami del sangue mostrano risultati leggermente più bassi, poiché esistono piccole quantità di metemoglobina (emoglobina ossidata) e carbossiemoglobina (emoglobina + monossido di carbonio (CO)) che non possono aderire all'ossigenica.
Tenendo conto di ciò, la regola di "Hüfner" stabilisce che, nel sangue, 1 g di emoglobina ha una capacità massima di unire l'ossigeno di 1.34 ml.
Curva di legame dell'ossiemoglobina
La quantità di molecole di ossigeno che possono essere unite a una molecola di emoglobina dipende dalla pressione parziale dell'ossigeno o dalla PO2. In assenza di ossigeno, l'emoglobina viene desossigenata, ma all'aumentare del PO2, il numero di ossigeno che si lega all'emoglobina aumenta.
Il processo di legame dell'ossigeno a emoglobina dipendente dalla pressione parziale dell'ossigeno. Durante il grafico, il risultato è chiamato "curva di oxihemoglobina" e ha una forma caratteristica di "s" o sigmoide.
Può servirti: tassismoA seconda del PO2, l'emoglobina avrà una capacità minore o maggiore di "rilasciare" o "consegnare" l'ossigeno che trasporta, oltre a caricare con questo.
Ad esempio, nella regione tra 10 e 60 mmHg di pressione si ottiene la parte con più in attesa della curva. In questa condizione l'emoglobina può facilmente produrre grandi quantità di O2. Questa è la condizione che si ottiene nei tessuti.
Quando il PO2 è compreso tra 90 e 100 mmHg (da 12 a 13 kPa), l'emoglobina è quasi al 100% satura di O2; E quando il PO2 arterioso è 60 mmHg (8 kPa) la saturazione con O2 è ancora alta fino al 90%.
Nei polmoni queste sono le condizioni che predominano (pressione tra 60 e 100 mmHg), e questo è che consente di caricare le molecole di emoglobina presenti negli eritrociti.
Questa forma sigmoidea che attira la curva di ossihemoglobina assicura che questa proteina si comporti come un eccellente caricabatterie a livello polmonare, un trasportatore molto efficiente nella pressione sanguigna e un eccellente donatore di O2 nei tessuti, in proporzione al tasso metabolico locale, cioè, cioè chiedere.
Riferimenti
- Fox, s. Yo. (2006). Fisiologia umana 9a edizione (pp. 501-502). McGraw-Hill Press, New York, USA.
- Murray, r. K., Granner, d. K., Mayes, p. A., & Rodwell, V. W. (2014). Biochimica illustrata di Harper. McGraw-Hill.
- Rawn, j. D. (1998). Biochimica (1989). Burlington, Carolina del Nord: Neil Patterson Publishers (C) N. Lalioti, cp raptopoulou, a. Terzis, a. Pangiotopoulos, perlepi sp e. Manessi-Zouopa, j. Chimica. Soc. Dalton Trans, 1327.
- Robert m. Berna, Matthew N. Levy. (2001) Fisiologia. (3a ed.) Edizioni Harcourt, s.A.
- West, J. B. (1991). Base fisiologiche della pratica medica. Williams & Wilkins
- « Caratteristiche di eritropoietina (EPO), produzione, funzioni
- Caratteristiche della distrofina, struttura e funzioni »

