Proprietà dei nitrati, struttura, nomenclatura, formazione
- 2650
- 250
- Silvano Montanari
IL Nitrati Sono tutti quei composti che non contengono anione no3-, Quando si tratta di sali inorganici o del gruppo nitro, -ono2, Nel caso dei derivati organici. In inorganico, tutti i nitrati sono sali di metallo o ioni di ammonio, in cui prevaleno interazioni elettrostaticheN+NO3-.
Ad esempio, nitrato di sodio3, È formato da ioni Na+ e non3-. Questo sale, insieme al nitrato di potassio, KNO3, sono i campioni di nitrati più abbondanti in natura. I nitrati trovano nei terreni, nei tessuti vegetali e soprattutto in depositi di mari e salini come Salitre, situati in Cile.
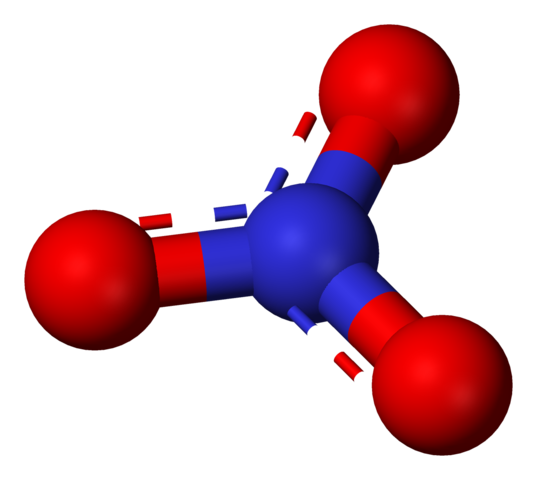
 Anione nitrato rappresentato da un modello di sfere e barre. Fonte: Benjah-BMM27 / Dominio pubblico.
Anione nitrato rappresentato da un modello di sfere e barre. Fonte: Benjah-BMM27 / Dominio pubblico. Il termine "nitrati" allude immediatamente a sali, fertilizzanti ed esplosivi. Sono anche legati alle carni e ai loro processi di indurimento per inibire la crescita dei batteri e quindi ritardare il loro deterioramento. I nitrati sono anche sinonimi di verdure, perché contengono elevate quantità di questi sali.
Lui non3- (Immagine superiore) è la forma più ossidata di azoto, essendo il prodotto finale e assimilabile del suo ciclo biologico. L'azoto dell'atmosfera subisce diverse trasformazioni, sia dal lavoro dei raggi elettrici che attraverso azioni microbiche, per diventare NH4+ e non3-, entrambi solubili in acqua e assorbibili dalle piante.
I nitrati sono usati come agenti ossidanti, fertilizzanti, esplosivi e farmaci cardiologici. Quest'ultimo uso contrasta molto con gli altri, mentre metabolizzano o interagiscono con il corpo in modo tale da dilastare le vene e le arterie; E quindi, c'è un aumento e un miglioramento del flusso sanguigno, alleviando i dolori cardiaci.
[TOC]
Proprietà dei nitrati
Neutralità
I nitrati sono in linea di principio sostanze neutre, come no3- È la base coniugata dell'acido nitrico, HNO3, Un forte acido. In acqua, non è apprezzabile:
NO3- + H2O ⇌ hno3 + OH-
In effetti, si può dire che questa idrolisi non si verifica affatto, la quantità di oh è spregevole-. Pertanto, le soluzioni di nitrati acquose sono neutri a meno che non vi siano altre sostanze disciolte.
Apparenze fisiche
I nitrati inorganici sono costituiti da sali le cui formule generali sono m (no3)N, essendo N È il Valencia o il carico positivo del catione metallico. Tutti questi nitrati hanno una luminosità cristallina e hanno colori bianchi. Tuttavia, i nitrati dei metalli di transizione possono essere colorati.
Ad esempio, nitrato di rame (II) o nitrato cupric, Cu (no3)2, È un solido cristallino bluastro. Nel frattempo, Nickel Nitrate (II), né (no3)2, È un colore smeraldo solido. Alcuni altri nitrati, come il ferro, presentano colori deboli.
D'altra parte, i nitrati organici sono generalmente solidi o solidi altamente sensibili ed esplosivi.
Può servirti: Living Matter: concetto, caratteristiche ed esempiDecomposizione termica
I nitrati metallici sono sensibili alle alte temperature, poiché iniziano a rompersi in base alla seguente equazione chimica:
2m (n3)2(s) → 2mo (s)+4no2(g)+o2(G)
Come osservato, il nitrato di metallo si decompone in un ossido, MO e diossido di azoto e ossigeno. Questa decomposizione termica non si verifica alla stessa temperatura per tutti i nitrati; Alcuni resistono più di altri.
Come regola generale, maggiore è il carico del catione m+, maggiore sarà la temperatura alla quale il nitrato deve essere riscaldato per rompere. Invece, quando m+ È piccolo o ha un grande carico positivo, il nitrato si decompone a temperature più basse, quindi più instabile.
Ad esempio, nitrato di sodio3, Si decompone a una temperatura inferiore a quella del nitrato di bario, BA (no3)2, Bene, sebbene il BA2+ avere un carico maggiore di NA+, Le sue dimensioni sono molto più grandi.
Agente ossidante
Lui non3- È un anione relativamente stabile. Tuttavia, il suo atomo di azoto è fortemente ossidato, con uno stato di ossidazione di +5 (n5+O32-), Quindi è "assetato" di elettroni. Per questo motivo, il nitrato è un agente ossidante, che cercherà di strappare elettroni a strappare le sostanze.
È questa mancanza di elettroni nell'atomo di azoto di NO3- Cosa fa il nano3 E kno3 forti agenti ossidanti, usati come componenti di polvere da sparo. Aggiungendo a questa caratteristica il fatto che i gas vengono rilasciati2 IO2 Durante la decomposizione, si capisce perché fa parte di molti esplosivi.
Quando il nitrato guadagna elettroni o si riduce, può essere trasformato in ammoniaca, NH3, o in ossido nitrico, no, a seconda dei reagenti e delle condizioni.
Solubilità
Tutti i nitrati inorganici, o ciò che è lo stesso, nitrati di metallo e ammonio, NH4NO3, Sono composti solubili in acqua. Questo perché le molecole d'acqua hanno una forte affinità per no3-, E che le reti cristalline di questi nitrati non sono molto stabili.
Struttura
Anione nitrato
 Strutture di risonanza di nitrati. Fonte: Benjah-BMM27 / Dominio pubblico.
Strutture di risonanza di nitrati. Fonte: Benjah-BMM27 / Dominio pubblico. L'immagine superiore mostra le strutture di risonanza dell'anione del nitrato. Come si può vedere, due cariche negative si trovano in due atomi di ossigeno, che sono democalizzati tra i tre atomi di ossigeno. Pertanto, ciascuno o ha un carico di -2/3, mentre l'azoto ha un carico +1.
Quindi, il no3- Interazione elettrostaticamente o collegamenti di coordinamento della forma, attraverso uno dei suoi tre atomi di ossigeno.
Solidi
Tutti i nitrati inorganici sono salini e ionici. Pertanto, le sue strutture sono cristalline, il che significa che i suoi ioni, m+ e non3-, Sono disposti nello spazio grazie alle loro interazioni elettrostatiche. A seconda di queste interazioni, i loro cristalli presenteranno strutture diverse.
Può servirti: qual è il rombo di sicurezza e a cosa serve?Ad esempio, la struttura cristallina di Nano3 È trigonale o rhomboédica, mentre quello del kno3 È ortorrombico.
Nitrati organici
I nitrati organici sono rappresentati con la formula generale Rono2, dove r è un gruppo alchil o aromatico. Questi composti sono caratterizzati dal loro collegamento R-AON2, e di solito è costituito da derivati nitrici di polimeri e altre sostanze organiche.
Complesso
Lui non3- Si coordina con i centri metallici per formare un collegamento M+-O NO2-, essere un'interazione diversa per ioniche. Questi complessi sono essenzialmente natura inorganica. Il nitrato può anche essere coordinato usando due dei suoi atomi di ossigeno allo stesso tempo, m+-O2NO.
Nomenclatura
Per nominare un nitrato, le parole "nitrato di" seguito dal nome del catione o dal gruppo che lo accompagna nella rispettiva formula chimica devono essere scritte per prime. Il valencia del catione è specificato tra parentesi quando ne possiede più di uno. Allo stesso modo, i suffissi possono essere usati -co e -oy se così preferiti, seguendo la nomenclatura tradizionale.
Ad esempio, considera la fede (no3)3. Il suo nome è il nitrato di ferro (III), perché la sua valenza è +3 o può anche essere chiamata nitrato ferrico.
Queste regole si applicano anche per nitrati organici, a condizione che le loro strutture siano semplici. Ad esempio, Cho3O NO2 Si chiama nitrato metilico, perché il gruppo -ch3 Diventa il gruppo r che accompagna -ono2.
Formazione
Naturale
I nitrati si formano in natura come parte del ciclo biologico di azoto. Per questo motivo, i terreni, i mari e alcune correnti d'acqua hanno quantità significative di nitrati. A seconda degli ioni circostanti, si formeranno diversi sali di nitrati, essendo nano3 E kno3 Il più comune e abbondante.
Industriale
I nitrati sono formati su scale industriali mediante neutralizzazione dell'acido nitrico, con idrossidi metallici, alcoli, polimeri, ecc. Ad esempio, nitrato di calcio, CA (no3)2, Può essere preparato in base alla seguente equazione chimica:
Ca (Oh)2 + 2hno3 → Ca (no3)2 + 2h2O
Allo stesso modo, diverse sostanze organiche vengono attaccate da HNO3 in determinate condizioni per promuovere la sostituzione di alcuni dei loro gruppi da -ono2. Questo è ciò che accade con la reazione della cellulosa per trasformarsi in nitrocellulosa o nitrato di cellulosa, un materiale polimerico ed esplosivo.
Fotocatalitico
L'anione no3-, E quindi nitrati inorganici, possono essere formati dall'azione fotocatalitica dei rifiuti di ossido di titanio, zio2, Usando come materia prima nient'altro che azoto e ossigeno d'aria. Questo studio presuppone che dove ci siano eccessi di ragazzo2, Ci saranno quantità indesiderate di no3-, che influenzano la potabilità idrica e possono includere alghe.
Può servirti: aldeideApplicazioni
Polimerizzazione di carne
 Le salsicce sono una delle carni trasformate che contengono più nitrati. Fonte: pxhere.
Le salsicce sono una delle carni trasformate che contengono più nitrati. Fonte: pxhere. I nitrati vengono aggiunti a diverse carni, in particolare salsicce, per eliminare i batteri e quindi ritardare il loro deterioramento. Reagiscono anche con le loro proteine per dare loro un colore più rossastro. Il problema di queste carni è che, cucinandole ad alte temperature, producono nitrosoamine: composti legati al cancro del colon.
Questa reazione è parzialmente evitata se ci sono vitamine presenti, come nel caso delle verdure, che sebbene siano ricche di nitrati, non sono associati a patologie cancerogene.
agricoltura
I nitrati sono una fonte di azoto solubile. Pertanto, funge da fertilizzante per contribuire con azoto alle piante e quindi favorire la loro crescita.
Medicinale
I nitrati hanno una funzione speciale nel corpo. Quando si assimila dall'azione enzimatica, viene ridotto a ossido nitrico, no. Questa molecola occupa il volume e dilata le vene e le arterie, permettendo di esserci un maggiore flusso sanguigno. Pertanto, i nitrati vengono utilizzati come farmaci per combattere le patologie del sistema circolatorio.
Ironico e curiosamente, a questo scopo nitrati organici come glicerilo, nitroglicerina, mononitrato isosorbido e pentarithritol tetranitrato sono stati usati, tutti buoni candidati nel mondo degli esplosivi.
Esplosivi
I nitrati sono usati in formulazioni esplosive, la polvere da sparo è l'esempio più simbolico. Essendo agenti ossidanti, favoriscono la combustione della materia, oltre a contribuire alla brusca espansione del volume a causa del loro rilascio di gas dopo la decomposizione.
Esempi di nitrati
Durante le sezioni precedenti sono stati menzionati più di un esempio di nitrati. Infine, alcuni altri saranno elencati insieme alle rispettive formule e nomi:
-Biancheria3: Nitrato di litio
-Rbno3: Nitrato Rubido
-Mg (n3)2: Nitrato di magnesio
-SC (n3)2: Nitrato scandio
-Cr (n3)3: Nitrato cromatico (III)
-Zn (n3)2: nitrato di zinco
-PB (n3)2: nitrato di piombo (ii)
-Agno3: nitrato d'argento
-Cap3Cap2O NO2: Nitrato etilico
-Cap3(Ch2)4O NO2: Nitrato Amilo
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Clark J. (5 giugno 2019). La stabilità termica dei nitrati e dei carbonati. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Wikipedia. (2020). Nitrato. Recuperato da: in.Wikipedia.org
- Angela Dowden. (12 marzo 2019). La verità sui nitrati nel tuo cibo. Estratto da: BBC.com
- Elsevier b.V. (2020). Nitrato. Scienceirect. Estratto da: ScienceDirect.com
- Dottore. Biji s. & Prof. Govindan v. (26 aprile 2017). Il ruolo dei nitrati organici nella gestione medica ottimale dell'angina. Società europea di cardiologia. Recuperato da: Escardio.org
- Yuan, s., Chen, j., Lin, z. et al. (2013). Formazione di nitrati da azoto atmosferico e ossigeno fotocatalizzato da biossido di titanio nano. Nat Commun 4, 2249. doi.org/10.1038/NCOMMS3249
- « Fondamenti di terapia narrativa di Michael White, procedura, tecniche
- Nomenclatura epossidica, ottenimento, applicazioni, esempi »

