Struttura del nitrato di piombo, proprietà, ottenimento, usi

- 3101
- 25
- Kayla Serr
Lui nitrato di piombo o Il nitrato di piombo (II) è un composto inorganico formato da elementi di piombo (Pb), azoto (N) e ossigeno (O). Il piombo si trova come ioni Pb2+ E l'azoto e l'ossigeno formano lo ione nitrato3-.
La sua formula chimica è Pb (no3)2. È un solido cristallino bianco molto solubile in acqua, dove forma ioni Pb2+ e non3-. È anche noto come nitrato a idraulico perché il piombo è nel suo stato di ossidazione più basso.
 Nitrato di piombo solido. Dominio Ondřej mangl / pub. Fonte: Wikimedia Commons.
Nitrato di piombo solido. Dominio Ondřej mangl / pub. Fonte: Wikimedia Commons. Ha proprietà fortemente ossidanti, quindi viene utilizzato nelle applicazioni in cui è richiesta questa caratteristica, come nella preparazione di vari composti organici e come reagente di laboratorio.
In passato era ampiamente usato per preparare i colori basati sul piombo, dove fungeva anche da riparatore dei colori nei tessuti. Questa applicazione è stata abbandonata a causa della tossicità del piombo.
È stato utilizzato nell'industria metallurgica in vari modi e recentemente è stata trovata la sua utilità, insieme ad altri composti, materiali con elevata capacità di assorbimento della luce e trasformazione di questo in elettricità.
Tuttavia, è una sostanza pericolosa perché può favorire la generazione di incendi. È anche tossico per essere umani, animali e piante, quindi non dovrebbe mai essere scartato nell'ambiente.
[TOC]
Struttura
È un composto ionico formato da un catione Pb2+ e due anioni no3-. Nel nitrato l'ossigeno dell'anione è disposto simmetricamente attorno a azoto e doppio legame alternativo con questo.
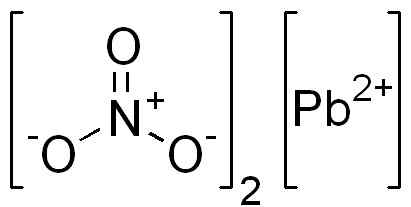 Struttura PB (no3)2. Dominio EDGAR181 / PUB. Fonte: Wikimedia Commons.
Struttura PB (no3)2. Dominio EDGAR181 / PUB. Fonte: Wikimedia Commons. 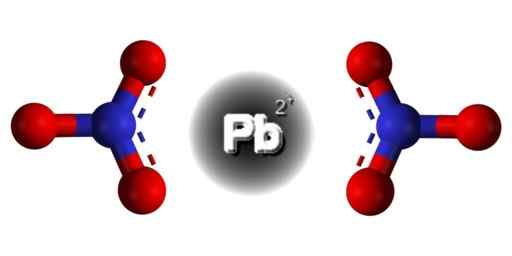 Struttura spaziale di Pb (no3)2. Grigio = piombo; blu = azoto; Rosso = ossigeno. Claudio Pistilli/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons.
Struttura spaziale di Pb (no3)2. Grigio = piombo; blu = azoto; Rosso = ossigeno. Claudio Pistilli/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons. Il piombo in questo composto ha la seguente configurazione elettronica:
[Xe] 4F14 5D10 6S2 6P0, dove si osserva che ha perso i 2 elettroni dell'ultimo strato.
Può servirti: qual è l'elemento più elettronegativo e perché?Nomenclatura
- Nitrato di piombo
- Nitrato di piombo (II)
- Nitrato Plumboso
- Piombo dinitrate
Proprietà
Stato fisico
Solido cristallino bianco o incolore. Cristalli cubici.
Peso molecolare
331 g/mol
Punto di fusione
470 ºC. Secondo alcune fonti, si decompone a questa temperatura.
Densità
4,53 g/cm3
Solubilità
Molto solubile in acqua: 59,7 g/100 ml di acqua a 25 ° C. Leggermente solubile in etanolo. Insolubile in acido nitrico (HNO3) concentrato.
ph
Una soluzione acquosa con 20% di Pb (no3)2 Ha un pH di 3.0-4.0.
Proprietà chimiche
È un agente ossidante. Reagisce violentemente con materiali combustibili e riduttori.
Non è carburante ma può accelerare la combustione dei materiali che sono. Se si riscuote fino alla sua decomposizione emette gas di ossido di azoto tossici:
2 pb (no3)2 + calore → 2 pbo + 4 no2↑ + o2↑
Quando si dissolve in acqua viene ionizzato:
PB (n3)2 + H2O → Pb2+ + 2 n3-
Ottenimento
Può essere preparato reagendo il piombo metallico, il monossido di piombo (PBO) o il carbonato di piombo3 Con acido nitrico. È conveniente utilizzare l'eccesso di acido per prevenire i nitrati di base.
PBO + 2 HNO3 (concentrato) → Pb (no3)2↓+ h2O
Applicazioni
In organico
La sua capacità ossidante ha applicazione nella preparazione di vari composti.
È stato usato per sintetizzare Calixarenos, che sono composti organici la cui molecola ha la forma di un cestino che consente di ospitare altre sostanze a seconda dell'uso che verrà dato ad esso.
Serve a ottenere isotiocianati (R-CS) a partire dalle ammine (R-NH2).
È usato su scala industriale per preparare il cloruro di benenchilo ossidante di benzaldeide. Serve anche come catalizzatore per l'esterificazione dei composti organici, ad esempio nell'ottenimento di poliesteri.
Nell'analisi chimica
È usato come reagente nella determinazione dell'alluminio e del piombo in minerali e rocce.
Nella colorazione delle fibre tessili
Alcuni coloranti cromati richiedono l'uso di PB (no3)2 ottenere. Ad esempio, tingere il giallo di cotone, è coperto di nitrato di piombo ed è trattato con solfato di sodio per produrre solfato di piombo.
Può servirti: peso equivalenteQuindi viene applicata una soluzione diluita di dicromato di sodio per formare il cromato di piombo (PBCRO4) Questo è un pigmento giallo.
 Un tempo fa i tessuti gialli erano colorati con pigmenti il cui punto di partenza era PB (no3)2. Questo non è fatto dalla tossicità del piombo. Autore: società di produzione di animazione 3D. Fonte: Pixabay.
Un tempo fa i tessuti gialli erano colorati con pigmenti il cui punto di partenza era PB (no3)2. Questo non è fatto dalla tossicità del piombo. Autore: società di produzione di animazione 3D. Fonte: Pixabay. Tuttavia, oggi i pigmenti principali per la loro tossicità sono stati smetti di usare.
Agisce anche come mordente per fissare i coloranti durante il colore o la stampa di altri tipi di fibre.
In Medina Veterinary
In precedenza era usato come agente caustico nel trattamento di Chancos o Gangrenas nei cavalli.
Nell'industria dei metalli
Il nitrato di piombo viene utilizzato nella raffinazione elettrolitica del piombo, come agente per favorire la flottazione nella rimozione del titanio di alcune argille, consente di recuperare preziosi metalli di soluzioni di cianuro e viene utilizzato nell'elettrodo PBO2 ad Nickel Anodes.
Nelle celle solari
È stato usato sotto forma di soluzione acquosa per produrre celle solari basate su Perovskita, un minerale di ossido di titanio.
Il materiale sintetizzato è un organometallico o pervskita di ioduro di piombo che ha attirato l'attenzione dei ricercatori, poiché ha un'alta capacità di assorbimento della luce e una grande lunghezza di diffusione dei portatori di carico.
Queste caratteristiche lo rendono un eccellente candidato per i dispositivi fotovoltaici, cioè trasformano la luce in corrente elettrica.
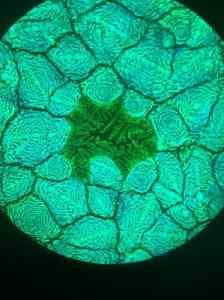 Microfotografia della struttura dell'UNAVSKITA di alogenuro di piombo assunto con microscopio a fluorescenza. Furava/cc di (https: // creativeCommons.Org/licenze/by/4.0). Fonte: Wikimedia Commons.
Microfotografia della struttura dell'UNAVSKITA di alogenuro di piombo assunto con microscopio a fluorescenza. Furava/cc di (https: // creativeCommons.Org/licenze/by/4.0). Fonte: Wikimedia Commons. Altre app
Lui (Pbno3)2 È stato anche usato:
- Nella produzione di corrispondenze, alcuni esplosivi e materiali pirotecnici,
- In fotografia come agente sensibilizzante per coprire la carta in fototermografia,
- Nell'industria tessile per migliorare il rayon e stabilizzare il nylon,
- Nell'eliminazione dei roditori.
 Il nitrato di piombo è stato utilizzato per produrre fuochi d'artificio o materiale pirotecnico. Autore: Free-Goos. Fonte: Pixabay.
Il nitrato di piombo è stato utilizzato per produrre fuochi d'artificio o materiale pirotecnico. Autore: Free-Goos. Fonte: Pixabay. Rischi
Fuoco ed esplosione
Sebbene non sia un composto di combustibile, se esposto al fuoco o al calore può esplodere, generando ossidi di azoto tossici.
Essere un agente fortemente ossidante c'è il pericolo che venga generato un incendio se viene a contatto con materiali organici.
Alla salute
Produce irritazione agli occhi, tratto respiratorio e digestivo. È tossico per inalazione e ingestione. I sintomi più comuni di avvelenamento da questo composto sono gastrointestinali, coliche, costipazione e debolezza che possono diventare paralisi di alcuni muscoli, tra gli altri, tra gli altri.
La sua ingestione può anche causare dolore, crampi, depressione, coma e morte.
Per l'ambiente naturale
È tossico per gli organismi acquatici e terrestri, inoltre i loro danni sono persistenti e bioaccumula negli esseri viventi, quindi è considerato un inquinante pericoloso e non dovrebbe essere scartato nell'ambiente.
Se per caso viene versato in acqua, dovrebbe essere neutralizzato con ossido di calcio (CAO), carbonato di calcio (Caco3) o bicarbonato di sodio (Nahco3).
È stato confermato che è cancerogeno per gli animali e forse per l'essere umano.
Riferimenti
- O.S. Biblioteca nazionale di medicina. (2019). Nitrato di piombo (ii). Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- HSIH, t.E. et al. (2015). Efficienti celle solari posvskite fabbricate utilizzando un precursore del nitrato di piombo acquoso. Chem Commun (Change). 4 settembre 2015; 51 (68): 13294-7. NCBI recuperato.Nlm.NIH.Gov.
- Vratny, f. e Guggiotta, F. (1963). La decomposizione temale del nitrato di piombo. J. Inorg. Nucl. Chimica., 1963, vol. 25, pp. 1129-1132. Recuperato da ScienceDirect.com.
- Chakraborty, j.N. (2014). Tintura con colori minerali. In fondi e pratiche in colorazione dei tessuti. Recuperato da ScienceDirect.com.
- Kumari, h. e Atwood, J. (2017). Calixareni a stato solido. In riferimento modulato in chimica, scienze molecolari e ingegneria chimica. Recuperato da ScienceDirect.com.
- Jeffery, p.G. e Hutchison, D. (1981). Alluminio. In Metodi chimici di analisi rocciosa (terza edizione). Recuperato da ScienceDirect.com
- Sandler, s.R. e Karo, W. (1992). Ciano, isocianati, tiocianesi e isotiocianati. In Sourcebook di preparati avanzati di laboratorio organico. Recuperato da ScienceDirect.com.
- Smith, p.W.G. et al. (1969). Composti alogeni aromatici. In chimica aromatica. Recuperato da ScienceDirect.com.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Piombo, d.R. (Editor) (2003). Manuale CRC di chimica e fisica. 85th CRC Press.
- Wikimedia Foundation (2020). Nitrato di piombo (ii). Recuperato da.Wikipedia.org.
- Shinde, d.V. et al. (2017). Efficacia e stabilità migliorata di un acquoso a base di celle solari a cella solare a base di cella solare a base di piombo a base di piombo. ACS Appl. Mater. Interfacce 2017, 9, 14023-14030. Recuperato dai pub.sindrome coronarica acuta.org.
- « Fenoli o proprietà dei composti fenolici, tipi, applicazioni
- Struttura dell'acetato di piombo, proprietà, ottenimento, usi »

