Struttura dell'acetato di piombo, proprietà, ottenimento, usi

- 3741
- 886
- Zelida Gatti
Lui Acetato di piombo o L'acetato di piombo (II) è un composto formato da uno ione di piombo (Pb2+) e due ioni acetato (CH3COO-). La sua formula chimica è (Cho3COO)2PB o anche PB (scegli3COO)2.
È anche noto come "zucchero piombo" per avere un sapore dolce. Tuttavia, è una sostanza molto velenosa. È un solido cristallino molto solubile in acqua. Puoi reagire facilmente con idrogeno solforato (h2S) Generazione del solfuro di piombo marrone (PBS), che viene utilizzato nella rilevazione di questo gas tossico nei processi industriali.
 Acetato di piombo solido (ii). DormotheMist presso l'inglese Wikipedia/CC di (https: // creativeCommons.Org/licenze/di/3.0). Fonte: Wikimedia Commons.
Acetato di piombo solido (ii). DormotheMist presso l'inglese Wikipedia/CC di (https: // creativeCommons.Org/licenze/di/3.0). Fonte: Wikimedia Commons. Nei tempi antichi è stato ottenuto con relativa facilità, quindi aveva usi che sono attualmente completamente vietati a causa della tossicità di questo composto.
La polvere di acetato di piombo non deve essere dispersa nell'ambiente, poiché forma miscele esplosive con ossigeno. Inoltre, è un composto cancerogeno per animali e umani.
È assorbito nei tessuti organici più facilmente rispetto ad altri composti di piombo. Tende a bioaccumulare negli esseri viventi, quindi non dovrebbe essere scartato nell'ambiente.
[TOC]
Struttura
L'acetato di piombo (II) ha la struttura mostrata nella figura seguente:
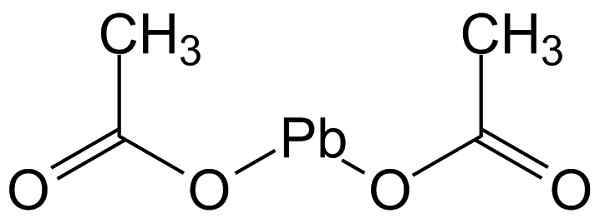 Struttura molecolare del piombo acetato (II). Michał Sobkowski/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons.
Struttura molecolare del piombo acetato (II). Michał Sobkowski/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons. Nomenclatura
- Acetato di piombo (II)
- Diacetato di piombo
- Piombo etanoato
- Acetato di Plumboso
- Sugar di piombo
- Sale di Saturno
Proprietà
Stato fisico
Cristallino solido incolore al bianco.
Peso molecolare
325 g/mol
Punto di fusione
280 ºC
Punto di ebollizione
Non bollire. Si rompe quando viene riscaldato.
Densità
3,25 g/cm3
Solubilità
Molto solubile in acqua: 44,3 g/100 ml a 20 ° C. Insolubile in alcol.
ph
Una soluzione acquosa al 5% ha un pH di 5,5-6,5.
Proprietà chimiche
Quando il PB (ococh3)2 Si dissolve in acqua Una parte è ionizzata come segue:
Pb (Ococh3)2 → Pb2+ + 2 ch3COO-
Tuttavia, parte delle molecole non è ionizzata e rimane nella forma:
Cap3COO-PB-OCOCH3.
Quando lo ione PB2+ Immettere la soluzione parzialmente idrolizzati nell'acqua che generano le specie PB4(OH)44+.
Le soluzioni acquose di acetato Pb (II) dissolvono l'ossido di piombo (PBO).
Può servirti: butenoReagisce con idrogeno solforato (H2S) formare un piombo marrone di solfuro di piombo (PBS).
Pb (Ococh3)2 + H2S → PBS + 2 CH3COOH
Se viene aggiunta una soluzione acquosa di ammoniaca (NH3) Un precipitato bianco o un solido acetato bianco dell'acetato di base si forma su un piombo dell'acetato di piombo.
Altre proprietà
Emette un odore simile a quello dell'aceto. Ha un sapore dolce. La sua forma commerciale più comune è Pb Triidrate (CH3COO)2 •3h2O.
 Triidrato acetato di piombo. LeIEM/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons.
Triidrato acetato di piombo. LeIEM/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons. Ottenimento
Può essere preparato dissolvendo l'ossido o il carbonato di piombo (II) in acido acetico concentrato. Piccole piastre di piombo metallico sottile possono anche essere usati.
PBO + 2 CH3COOH → (CH3COO)2Pb + H2O
Usi antichi
In medicina
È stato usato in soluzione diluita per applicarlo come impiastro e lavato in infiammazioni causate da edera velenosa e come astringente nelle lozioni. Anche per curare la diarrea.
Nei trattamenti veterinari
È stato usato come una lozione astringente e sedativa nel trattamento delle infiammazioni e dei lividi superficiali.
In cosmetici
Era prodotto in tempi romani antichi. Alcune donne lo hanno applicato al loro viso per apparire pallido, il che non era solo una moda, ma una questione di status sociale.
Una carnagione bianca ha indicato che la donna non apparteneva alla classe operaia, ma ai più alti livelli di società romana. E questo è successo nonostante il fatto che i medici dell'epoca, come Plinio El Viejo, conoscevano alcuni dei suoi effetti dannosi.
Come dolcificante di bevande
A causa del suo sapore dolce, è stato usato nell'antichità come sostituto dello zucchero, specialmente nel vino e per addolcire e conservare i frutti.
In diverse applicazioni
Alcuni di questi usi si applicano ancora, ma la letteratura consultata non è chiara al riguardo:
- Nei pigmenti cromati, come componente nei coloranti adesivi, in saponi organici secchi per dipinti, vernici e inchiostri, come il repellente per l'acqua, nelle vernici anti -mobili.
- Nel processo di ottenere oro da parte di cianuri, per coprire i metalli con il piombo.
- Come mordente nei coloranti di cotone, componente del fissaggio di bagni per la carta con la luce solare.
- Trattare le tende da sole e i mobili per esterni e quindi prevenire la rimozione di agenti che proteggono dal deterioramento delle muffe e delle piogge.
Usi attuali
In H rilevamento2S
In alcuni processi industriali viene utilizzato per rilevare tossici H2S in correnti gassose attraverso un ruolo di prova in cui funge da indicatore. Il limite di rilevamento è di 5 ppm (parti per milione).
 L'acetato di piombo (II) consente di rilevare H2S nei gas industriali in modo che questo gas tossico non sia rilasciato nell'atmosfera. Autore: Leestilltaolcom. Fonte: Pixabay.
L'acetato di piombo (II) consente di rilevare H2S nei gas industriali in modo che questo gas tossico non sia rilasciato nell'atmosfera. Autore: Leestilltaolcom. Fonte: Pixabay. Nei recenti test, le nanofibras sono state incorporate insieme a un polimero che si traduce in un nuovo materiale di rilevamento che consente la presenza di 400 ppb (parti per miliardo) di H2S uniforme l'umidità del 90%.
L'alto potenziale di questo nanomateriale come sensore colorimetrico lo rende applicabile al rilevamento di H2S nel respiro delle persone che soffrono di alitosi, la cui gamma è inferiore a 1 ppm.
 Le nuove nanofibre contenenti PB (CH3COO)2 Possono rilevare quantità molto piccole di h2S in respiro. Autore: Natalia Ovcharenko. Fonte: Pixabay.
Le nuove nanofibre contenenti PB (CH3COO)2 Possono rilevare quantità molto piccole di h2S in respiro. Autore: Natalia Ovcharenko. Fonte: Pixabay. Nel ottenere altri composti
Permette di preparare altri composti di piombo come carbonato e cromato, sali di piombo di alto peso molecolare e acidi grassi antiossidanti per la gomma.
Per uso esterno
Secondo alcune fonti consultate, questo composto è ancora usato nelle coloranti per capelli le cui indicazioni dell'applicazione avvertono che non dovrebbe essere utilizzato in altre parti del corpo diverse dal cuoio capelluto.
Fa anche parte dell'uso esterno prodotti analgesici e protezioni della pelle.
Tuttavia, in entrambi i casi non ci sono prove sufficienti per stabilire il grado di sicurezza di questi prodotti, quindi in paesi come il Canada e nello stato degli Stati Uniti della California, il suo uso in tutti i tipi di cosmetici o per l'applicazione è stato proibito sulla pelle.
Rischi
Per sicurezza
Non è carburante, ma è disperso nell'ambiente sotto forma di particelle fine può generare miscele esplosive con l'aria.
Dovrebbe essere conservato lontano da composti ossidanti, acidi forti e metalli chimicamente attivi e in aree senza scarichi o accesso alle fogne che portano a fognature.
Alla salute
Può irritare gli occhi, il tratto respiratorio e il digestivo, causando mal di testa, nausea, vomito, colica, debolezza muscolare, crampi, convulsioni, paralisi, vertigini, perdita di coscienza, coma e persino morte.
Può servirti: acido iposulfuroL'acetato di piombo viene assorbito circa 1,5 volte più velocemente rispetto ad altri composti di piombo.
 Il piombo acetato colpisce negativamente il cervello dei bambini. Autore: Pete Lyforth. Fonte: Pixabay.
Il piombo acetato colpisce negativamente il cervello dei bambini. Autore: Pete Lyforth. Fonte: Pixabay. Una concentrazioni ematiche molto basse nei bambini può causare iperattività o disabilità neuroconduttuale, poiché genera effetti sul sistema nervoso. Può anche produrre anemia e danni ai reni.
Nel caso degli animali è stato sufficientemente dimostrato che è tossico per la riproduzione, cancerogeno e teratogenico. Si stima che gli esseri umani influenzassero allo stesso modo.
Per l'ambiente
È considerata una sostanza pericolosa per l'ambiente, in quanto è un inquinante tossico. È molto dannoso per gli organismi acquatici. Particolare attenzione dovrebbe essere prestata agli uccelli, ai mammiferi, all'inquinamento del suolo e alla qualità dell'acqua.
Può verificarsi bioacumulazione di questo composto nelle piante e negli animali. Le istituzioni ecologiche internazionali non consentono fortemente di entrare nell'ambiente perché è persistente.
Caso di avvelenamento storico
Uno degli eventi studiati è stato quello del presidente degli Stati Uniti Andrew Jackson (1767-1845), che ha subito un trattamento con "zucchero di piombo", che a quel tempo era un rimedio tradizionale con vari scopi.
Nel 1999 sono state fatte misure a due campioni di capelli ottenuti nella vita del Presidente e si è scoperto che i livelli di piombo erano molto elevati in entrambi i campioni, il che è compatibile con i sintomi del idraulico che ha sofferto.
 Andrew Jackson è stato ubriaco da rimedi a base di piombo. Autore: Gordon Johnson. Fonte: Pixabay.
Andrew Jackson è stato ubriaco da rimedi a base di piombo. Autore: Gordon Johnson. Fonte: Pixabay. Sia le loro lettere che il loro biografo descrivono che ha presentato sintomi come nausea, crampi addominali e reumatismo paralitico, tra gli altri. Ma dopo un po 'Jackson ha abbandonato il trattamento dell'acetato di piombo, quindi la sua salute è migliorata.
Pertanto, si stima che la sua morte non fosse probabilmente dovuta all'avvelenamento da piombo.
Riferimenti
- O.S. Biblioteca nazionale di medicina. (2019). Acetato di piombo (ii). Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Piombo, d.R. (Editor) (2003). Manuale CRC di chimica e fisica. 85th CRC Press.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Ghazi, a.M. e Millette, J.R. (1964). Guida. Acetato di piombo. In ambientale forense. Recuperato da ScienceDirect.com.
- Mushak, p. (2011). Piombo e salute pubblica. In trace metalli e contaminanti invidiati. Recuperato da ScienceDirect.com.
- Cha, j.-H. et al. (2018). Sensore colorimetrico di idrogeno solfuro di idrogeno solforato: nanofibre a piombo per la diagnosi di alitosi. Anal Chem 2018 7 agosto; 90 (15): 8769-8775. NCBI recuperato.Nlm.NIH.Gov.
- Wikimedia Foundation (2020). Acetato di piombo (ii). Recuperato da.Wikipedia.org.
- Stewart, s. (2015). "Bianco luccicante e mortale". Una carnagione giusta. Nella storia della tossicologia e della salute ambientale. Recuperato da ScienceDirect.com.
- Deppisch, l.M. et al. (1999). L'esposizione di Andrew Jackson al mercurio e al piombo: presidente avvelenato? Jama 1999 agosto 11; 282 (6): 569-71. NCBI recuperato.Nlm.NIH.Gov.
- « Struttura del nitrato di piombo, proprietà, ottenimento, usi
- Struttura di ioduro di piombo, proprietà, ottenimento, usi »

