Molalità

- 2759
- 167
- Ruth Cattaneo
Cos'è la moleality?
IL Molalità, indicato con la lettera M in minuscolo, è un termine usato per descrivere la concentrazione di una soluzione. Può essere definito come il numero di moli di un soluto disciolto in 1 chilogrammo di solvente.
È uguale alle moli di soluto (la sostanza che si dissolve) divisa per i chilogrammi di solvente (la sostanza usata per dissolversi).

Dove le talpe di soluto sono fornite dall'equazione:
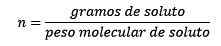
Quindi, alla fine, l'equazione della moleity rimane
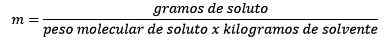
Caratteristiche della molealizzazione
- La molalità è una misura della concentrazione di un soluto in una soluzione. Viene utilizzato principalmente quando la temperatura è una preoccupazione.
- La molalità non è comune come la sua controparte, la molarità (moli di soluto per ogni litro di solvente), ma viene utilizzata in calcoli molto specifici, in particolare per quanto riguarda le proprietà coligative (elevazione del punto di ebollizione, depressione del punto di congelamento). Poiché il volume è soggetto a variazioni dovute a temperatura e pressione, anche la molarità varia in base alla temperatura e alla pressione.
- In alcuni casi, l'uso del peso è un vantaggio perché la massa non varia con le condizioni ambientali.
- È importante che la massa del solvente e non la massa della soluzione venga utilizzata.
- Le soluzioni contrassegnate con concentrazione morale sono indicate con un m minuscolo. Una soluzione da 1,0 m contiene 1 mol di soluto per chilogrammo di solvente.
- La preparazione di una determinata soluzione morale è facile perché richiede solo una buona scala. Sia il solvente che il soluto sono miscelati, invece di essere misurati in volume.
Può servirti: acido propano- L'unità SI (sistema internazionale) per moleity è mol/kg o soluti di moli per kg di solvente. Una soluzione con una moleità di 1 mol/kg è spesso descritta come "1 mole" o "1 m".
Tuttavia, seguendo il sistema di unità SI, il National Institute of Standards and Technology, che è l'autorità degli Stati Uniti alla misurazione, ritiene che il termine "morale" e il simbolo dell'unità "M" sia obsoleto e suggerisce di usare mol/kg.
Differenze e somiglianze tra moleality (M) e molarità (M)
La preparazione di una soluzione di una determinata moralità implica pesare sia il soluto che il solvente e l'ottenimento delle sue masse.
Ma nel caso della molarità, viene misurato il volume della soluzione, che lascia spazio per variazioni di densità a seguito della condizione ambientale e di pressione.
Ciò significa che è una pressione vantaggiosa mentre l'impasto rimane invariato.
Inoltre, le reazioni chimiche avvengono in proporzione di massa e non il volume. Per fare affidamento sull'impasto, la moleality può facilmente diventare un rapporto di massa o una frazione di massa.
Per soluzioni acquose (soluzioni in cui l'acqua è solvente) vicino alla temperatura ambiente, la differenza tra soluzioni morali e molari è spregevole.
Questo perché intorno alla temperatura ambiente, l'acqua ha una densità di 1 kg / l. Ciò significa che la "per l" della molarità è uguale al "per kg" della molealità.
Può servirti: Caseinato di calcio: struttura, proprietà, ottenimento e usiPer un solvente come l'etanolo, dove la densità è 0,789 kg / L, una soluzione da 1 m sarebbe 0,789 m.
La parte importante del ricordare la differenza è:
Molarità - M → Mali per litro di soluzione.
MOLAGIONA - M → Mali per chilogrammo di solvente.
Esempi di moleality
Esempio 1
Problema: Qual è la moralità di una soluzione contenente 0.086 moli di NaCl disciolti in 25,0 g di acqua?
Risposta: In questo esempio, viene utilizzata l'equazione morale diretta:
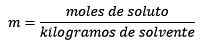
Moli di soluto (NaCl) = 0,086 mol mol
Massa (acqua) = 25,0 g = 25,0 x 10-3 kg
Sostituire che hai:
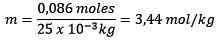
Esempio 2
Problema: Qual è la moralità di una soluzione se 124,2 grammi di Naoh si dissolvono in 1,00 litri di acqua? (La densità dell'acqua è pari a 1,00 g/mL).
Risposta: L'acqua è conosciuta come il solvente universale e la densità è generalmente somministrata circa 1,00 grammi per millilitro, o ciò che è lo stesso, 1 chilogrammo per litro. Ciò facilita la conversione dai litri in chilogrammi.
In questo problema, i 124,2 grammi di NaOH dovranno essere convertiti in moli (per moli di soluto) e un litro di acqua dovrà essere trasformato in chilogrammi (con chilogrammi di solvente) usando la densità.
Innanzitutto, c'è la massa molare di Naoh:
P.mN / a= 22,99 g/mol
P.mO= 16 g/mol
P.mH= 1g/mol
P.mNaoh= 22,99 g/mol +16 g/mol +1 g/mol = 39,99 g/mol
In secondo luogo, i grammi di Naoh si convertono in talpe, usando l'impasto molare:
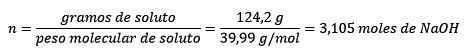
In terzo luogo, il litro d'acqua diventa chilogrammi usando la densità:
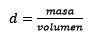
Cancellare l'impasto, rimane:
Può servirti: ossido d'oro (iii) (Au2o3): cosa è, struttura, proprietà, usi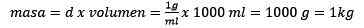
Infine, l'equazione del molelismo viene risolta:
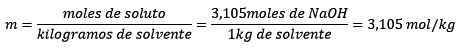
Esempio 3
Problema: Qual è la massa d'acqua di una soluzione acquosa che contiene 0,52 grammi di cloruro di bario (Bacl2, PM = 208,23 g/mol) la cui concentrazione è 0,005 mol/kg?
Risposta: In questo caso la concentrazione morale viene utilizzata per determinare la quantità di acqua in soluzione.
Innanzitutto, si ottiene il numero di moli di bacl2 Nella soluzione:
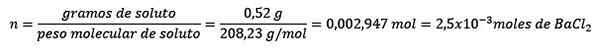
In secondo luogo, i chilogrammi di solvente vengono eliminati dall'equazione del molelismo e risolti.
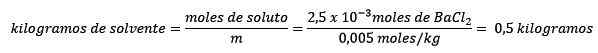
Riferimenti
- Calcolo del problema dell'esempio della molalità. Recuperato da Sciententes.org.
- Qual è un esempio di molalità? Recuperato da Socratic.org.
- (S.F.). Moralità. Recuperato da illimitato.com.

